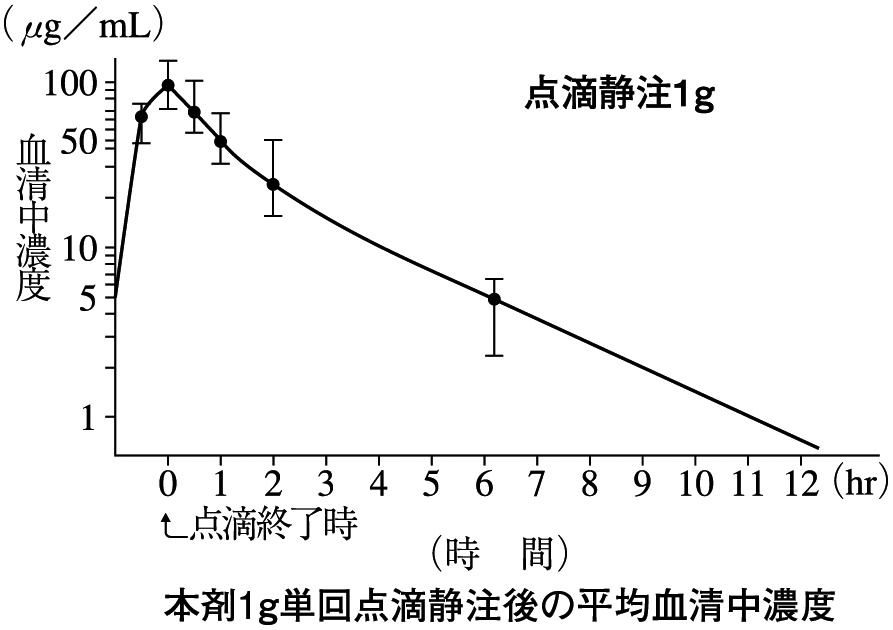
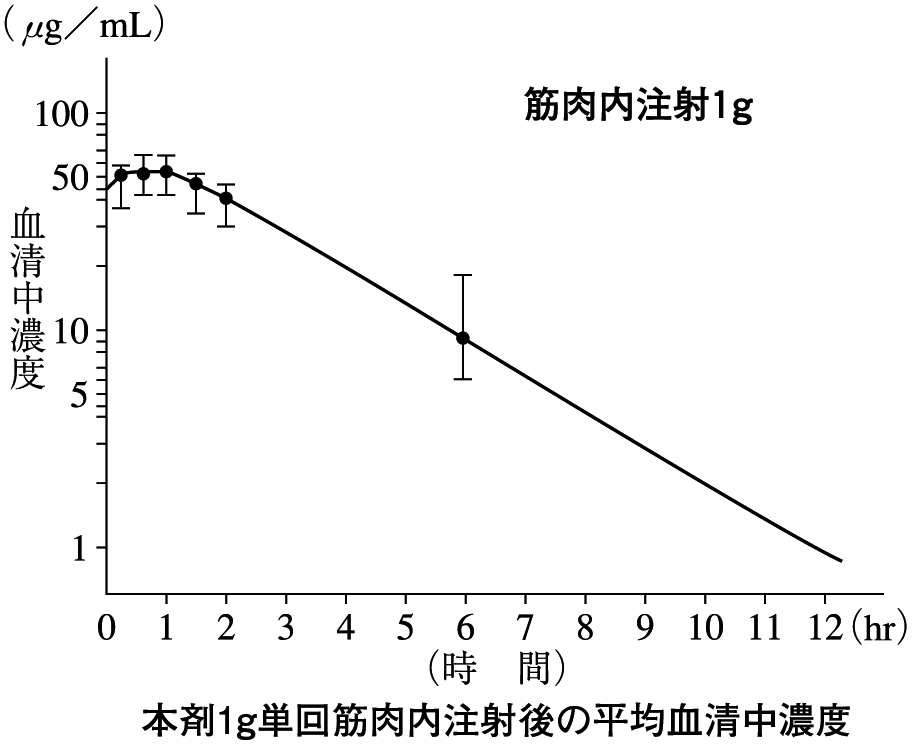
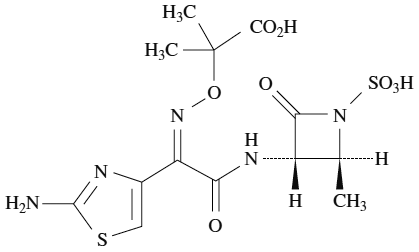
1
厚生労働省健康局結核感染症課:抗微生物薬適正使用の手引き 第二版, 2019;2:1-95[ZZZ-0873]
2
Nakashima M. et al.:臨床薬理, 1985;16(2):409-416[AZT-0045]
3
鈴山洋司ら:日本化学療法学会雑誌, 1985;33(S.1):505-519[AZT-0086]
4
谷村 弘ら:日本化学療法学会雑誌, 1985;33(S.1):628-658[AZT-0101]
5
奥沢星二郎ら:日本化学療法学会雑誌, 1985;33(S.1):571-576[AZT-0096]
6
藤井良知ら:Jpn. J. Antibiot., 1985;38(11):3195-3216[AZT-0268]
7
高瀬善次郎ら:産婦人科の世界, 1985;37(12):1303-1318[AZT-0290]
8
富井隆夫ら:日本化学療法学会雑誌, 1985;33(S.1):139-142[AZT-0043]
9
藤田公生ら:日本化学療法学会雑誌, 1985;33(S.1):132-133[AZT-0042]
10
馬場駿吉ら:Jpn. J. Antibiot., 1986;39(1):159-176[AZT-0294]
11
水野全裕ら:日本化学療法学会雑誌, 1985;33(S.1):126-131[AZT-0041]
12
小林宏行ら:日本化学療法学会雑誌, 1985;33(S.1):389-394[AZT-0063]
13
熊本悦明ら:泌尿器科紀要, 1985;31(11):2090-2104[AZT-0291]
14
鈴木恵三ら:日本化学療法学会雑誌, 1985;33(S.1):729-756[AZT-0112]
15
馬場駿吉ら:耳鼻と臨床, 1986;32(1):93-112[AZT-0295]
16
大石正夫ら:臨床眼科, 1985;39(7):967-974[AZT-0128]
17
藤井良知ら:Jpn. J. Antibiot., 1988;41(4):390-398[AZT-0446]
18
斎藤 篤ら:感染症学雑誌, 1985;59(11):1084-1120[AZT-0289]
19
大森弘之ら:Jpn. J. Antibiot., 1988;39(1):24-56[AZT-0292]
20
横田 健ら:日本化学療法学会雑誌, 1985;33(S.1):14-23[AZT-0028]
21
大槻雅子ら:日本化学療法学会雑誌, 1985;33(S.1):54-74[AZT-0025]
22
小川道雄ら:日本化学療法学会雑誌, 1985;33(11):963-968[AZT-0267]
23
五島瑳智子ら:日本化学療法学会雑誌, 1985;33(S.1):39-53[AZT-0024]
24
三橋 進ら:本化学療法学会雑誌, 1985;33(S.1):1-13[AZT-0023]
25
紀藤恭輔ら:日本化学療法学会雑誌, 1985;33(S.1):87-114[AZT-0026]