1
大橋輝久,ほか:西日本泌尿器科. 1978;40:172-179
2
鴨井逸馬,ほか:日本医学放射線学会雑誌. 1976;36:993-1005
3
川上憲司,ほか:現代の診療. 1976;18:607-615
4
菅原盛家,ほか:核医学. 1978;15:1155-1163
5
藤田 透,ほか:核医学. 1980;17:219-227

放射性医薬品/副腎疾患診断薬
1MBq 1084円
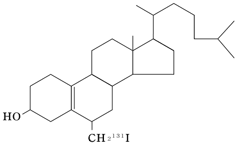
有効成分 | 1バイアル中 0.5mL 6β-ヨードメチル-19-ノル-コレスト-5(10)-エン-3β-オール(131I)(検定日時) 18.5MBq |
|---|---|
有効成分 | 1バイアル中 1mL 6β-ヨードメチル-19-ノル-コレスト-5(10)-エン-3β-オール(131I)(検定日時) 37MBq |
添加剤 | 1バイアル中 0.5mL エタノール 0.008mL ポリソルベート80 0.016mL 生理食塩液 適量 1バイアル中 1mL エタノール 0.016mL ポリソルベート80 0.032mL 生理食塩液 適量 |
| pH | 5.5~7.0 |
|---|---|
| 浸透圧比 | 約2(生理食塩液に対する比) |
| 外観 | 無色澄明の液 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
ジスルフィラム、シアナミド、プロカルバジン塩酸塩 | これら薬剤とのアルコール反応(顔面潮紅、血圧降下、悪心、頻脈、めまい、呼吸困難、視力低下等)を起こすおそれがある。 | 本剤はエタノールを含有しているため。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
N-メチルテトラゾールチオメチル基を有するセフェム系抗生物質(セフメノキシム塩酸塩等)、メトロニダゾール | これら薬剤とのアルコール反応(顔面潮紅、悪心、頻脈、多汗、頭痛等)を起こすおそれがある。 | 本剤はエタノールを含有しているため。 |
0.1%~5% | 頻度不明 | |
|---|---|---|
過敏症 | 発疹 | 発赤 |
循環器 | 動悸、顔面紅潮、徐脈 | 頻脈、血圧上昇、顔面蒼白 |
消化器 | 嘔気、嘔吐 | |
その他 | めまい、頭痛、発汗、息苦しさ、腹部痛 | 胸部、背部、腰部等の痛み、顔面・四肢のしびれ、気分不良、不快感、冷汗、脱力、熱感、けいれん、目のちらつき、悪寒 |
臓器 | 吸収線量(mGy/18.5MBq) |
全身 | 4.4 |
肺 | 8.4 |
肝臓 | 8.0 |
脾臓 | 8.9 |
副腎 | 791.2 |
腎臓 | 4.6 |
睾丸 | 3.7 |
卵巣 | 40.3 |
経過日数 (日) | 残存放射能 (%) | 経過日数 (日) | 残存放射能 (%) | 経過日数 (日) | 残存放射能 (%) |
−3 | 129.6 | 8 | 50.1 | 19 | 19.4 |
−2 | 118.9 | 9 | 45.9 | 20 | 17.8 |
−1 | 109.0 | 10 | 42.1 | 21 | 16.3 |
0 | 100 | 11 | 38.7 | 22 | 14.9 |
1 | 91.7 | 12 | 35.5 | 23 | 13.7 |
2 | 84.1 | 13 | 32.5 | 24 | 12.6 |
3 | 77.2 | 14 | 29.8 | 25 | 11.5 |
4 | 70.8 | 15 | 27.4 | 26 | 10.6 |
5 | 64.9 | 16 | 25.1 | 27 | 9.7 |
6 | 59.5 | 17 | 23.0 | 28 | 8.9 |
7 | 54.6 | 18 | 21.1 | 29 | 8.2 |