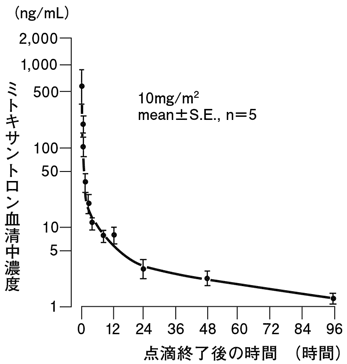
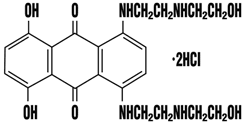
1
Smith,J.F,ed.Pharmanual,a comprehensive guide to the therapeutic use of Novantrone.Chicago:Pharma Libri;1984
2
幸保文治他:医薬ジャーナル.1987;23(9):1879-1891
3
社内資料:安定性試験
4
小川一誠他:癌と化学療法.1986;13(10):3028-3033
5
社内資料:CL 232,315の蛋白結合
6
Ehninger,G.et al.:Cancer Treat.Rep.1986;70(12):1373-1378
7
Chiccarelli,F.S.et al.:Cancer Res.1986;46(9):4858-4861
8
社内資料:臨床成績集計
9
Johnson,R.K.:Cancer Treat.Rep.1979;63(3):425-439
10
Osheroff,N.et al.:Advances Pharmacol.1994;29B:105-126
11
Wallace,R.E.et al.:Cancer Res.1979;39(5):1570-1574
12
Goldin,A.et al.:Cancer Treat.Rev.1980;7(4):167-176
13
Durr,F.E.et al.:Am.Soc.Microbiology.1980:1595-1596
14
Kimler,B.F.et al.:Cancer Res.1982;42(9):3631-3636
15
Fujimoto,S.et al.:Cancer Chemother.Pharamacol.1982;8(2):157-162
16
佐藤 博:癌と化学療法.1982;9(1):26-30
17
奥田博明他:化学療法の領域.1988;4(9):133-137