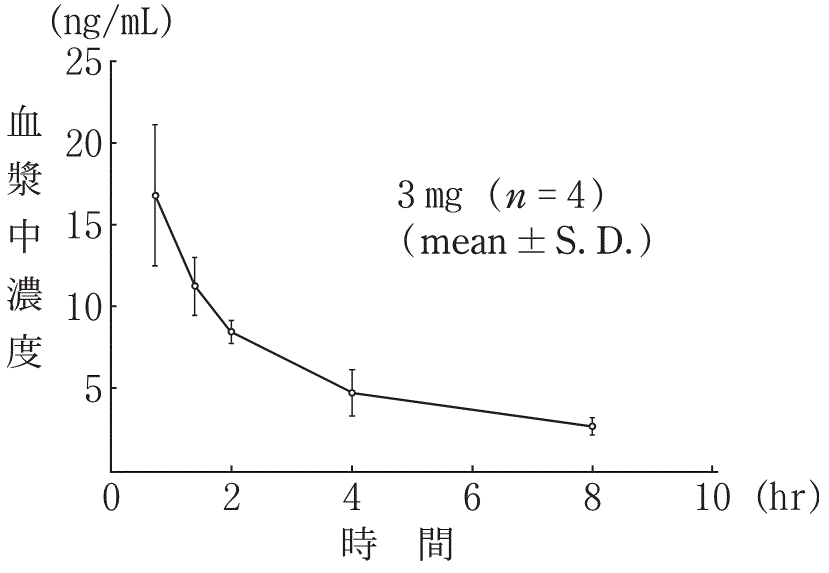
1
Luedke D., et al.:Cancer. 1985;55(3):542-545
2
Fiorentino M. V., et al.:Cancer Treat. Rep. 1982;66(5):1247-1248
3
Robbins G., et al.:Br. Med. J. 1985;291:1094
4
社内資料:血漿中Vindesine 濃度のRadioimmunoassay(1983年)
5
社内資料:悪性腫瘍患者における薬動力学的検討(1983年)
6
社内資料:ラットにおける分布,排泄及び代謝(1983年)
7
社内資料:ラットの妊娠母獣組織内及び胎仔における分布、乳汁移行並びに代謝(1984年)
8
Zhou X. J., et al.:Biochem. Pharmacol. 1993;45(4):853-861
9
Owellen R. J., et al.:Cancer Res. 1977;37:2603-2607
10
木村禧代二 他:癌と化学療法. 1983;10(12):2509-2515 ほか
11
Iizuka T., et al.:Jpn. J. Clin. Oncol. 1989;19(4):380-383