1
Paul W, et al.:Br J Pharmacol. 1993; 110: 1565-1571
2
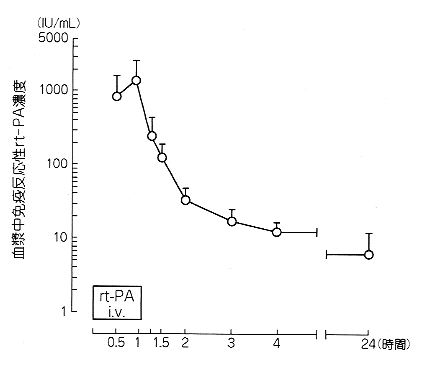
社内資料:急性心筋梗塞患者における体内動態(1991年3月29日承認、申請資料概要へ-2-1、3.)
3
飯田成宇ほか:薬物動態. 1988; 3: 309-329
4
岩本正人ほか:薬理と治療. 1988; 16: 1259-1268
5
社内資料:第Ⅰ相臨床試験成績(第1報)(1991年3月29日承認、申請資料概要ト-1-1)
6
Yamaguchi T, et al.:Stroke. 2006; 37: 1810-1815
7
The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group:N Engl J Med. 1995;
333: 1581-1587
333: 1581-1587
8
新谷博一ほか:医学のあゆみ. 1991; 6: 429-451
9
Hoylaerts M, et al.:J Biol Chem. 1982; 257: 2912-2919
10
山本登志弘ほか:薬理と治療. 1988; 16: 1203-1213
11
比護勝哉ほか:薬理と治療. 1988; 16: 1223-1229
12
山本登志弘ほか:薬理と治療. 1988; 16: 1215-1221
13
Umemura K, et al.:Pathophysiol Haemost Thromb. 2008; 36: 245-250