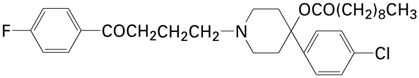1
寺内嘉章, ほか:神経精神薬理. 1985 ; 7:849-854
2
老田哲也, ほか:薬理と治療. 1985 ; 13:5109-5126
3
Tsang MW, et al.:J Clin Psychopharmacol. 1994 ; 14:159-162
4
Tyndale RF, et al.:Br J Clin Pharmacol. 1991 ; 31:655-660
5
Fang J, et al.:Cell Mol Neurobiol. 1997 ; 17:227-233
6
Matsunaga Y, et al.:Arzneim-Forsch/Drug Res. 1986 ; 36:453-456
7
伊藤 斉, ほか:神経精神薬理. 1985 ; 7:881-890
8
伊藤 斉, ほか:神経精神薬理. 1985 ; 7:961-969
9
伊藤 斉, ほか:神経精神薬理. 1985 ; 7:855-865
10
山本智之, ほか:臨床医薬. 1985 ; 1(Suppl.):97-106
11
大久保善朗, ほか:神経精神薬理. 1985 ; 7:905-916
12
平野敬之, ほか:神経精神薬理. 1985 ; 7:917-927
13
工藤義雄, ほか:神経精神薬理. 1985 ; 7:947-960
14
大熊輝雄, ほか:神経精神薬理. 1985 ; 7:983-996
15
大日本製薬:JNHPA. 1975 ; 11:285-288
16
Niemegeers CJE, et al.:Proc R Soc Med. 1976 ; 69(Suppl. 1):3-8
17
Andén NE, et al.:Eur J Pharmacol. 1970 ; 11:303-314
18
Oka M, et al.:Arch Int Pharmacodyn Ther. 1985 ; 277:289-302
19
社内資料:ハロペリドールデカン酸エステルの嘔吐抑制作用
20
Janssen PAJ, et al.:Arzneim-Forsch. 1965 ; 15:104-117
21
Janssen PAJ, et al.:Arzneim-Forsch. 1968 ; 18:261-279
22
清水当尚, ほか:応用薬理. 1973 ; 7:289-316