1
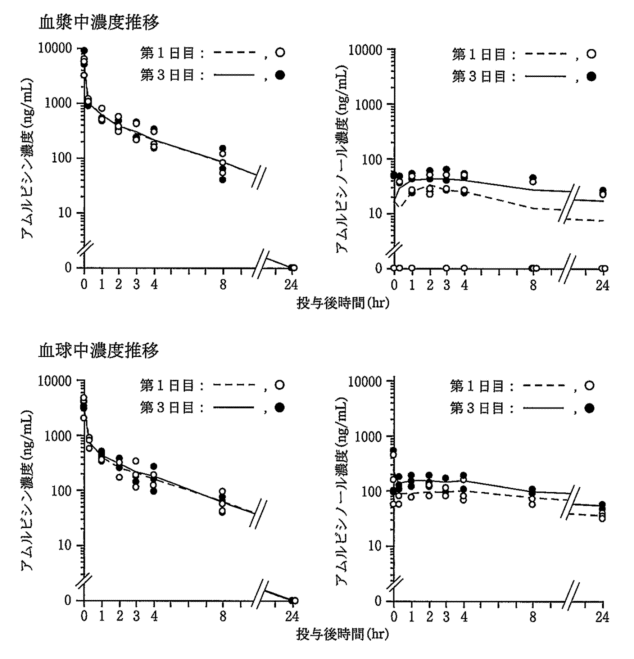
社内資料: 3日間連日静脈内投与での薬物動態(2002年4月11日承認、申請資料概要へ)
2
仲井俊司ほか: 薬物動態. 1998; 13: 61-77
3
仲井俊司ほか: 薬物動態. 1998; 13: 100-112
4
Sawa T., et al.: Invest. New Drugs. 2006; 24: 151-158
5
Takeda K., et al.: Invest. New Drugs. 2007; 25: 377-383
6
Sugiura T., et al.: Invest. New Drugs. 2005; 23: 331-337
7
Yana T., et al.: Invest. New Drugs. 2007; 25: 253-258
8
Hanada M., et al.: Jpn. J. Cancer Res. 1998; 89: 1229-1238
9
社内資料: アムルビシン塩酸塩の過酸化脂質生成作用(2002年4月11日承認、申請資料概要ホ-1)
10
Morisada S., et al.: Jpn. J. Cancer Res. 1989; 80: 69-76
11
Hanada M., et al.: Cancer Sci. 2007; 98: 447-454
12
Yamaoka T., et al.: Jpn. J. Cancer Res. 1998; 89: 1067-1073
13
Yamaoka T., et al.: Jpn. J. Cancer Res. 1999; 90: 685-690