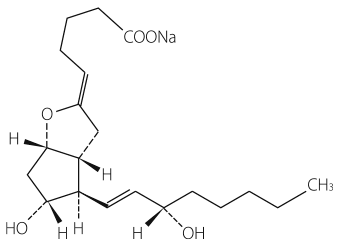
1
Skrinska VA,et al.:J Lab Clin Med.1986;107:187-193
2
Taylor BM,et al.:J Pharmacol Exp Ther.1980;214:24-30
3
Lucas FV,et al.:Thromb Res.1986;43:379-387
4
Taylor BM,et al.:J Pharmacol Exp Ther.1983;224:692-698
5
Brash AR,et al.:J Pharmacol Exp Ther.1983;226:78-87
6
国枝武義ほか:臨床医薬.1998;14:1091-1119
7
社内資料:国内臨床試験
8
国枝武義ほか:Prog Med.2003;23:3011-3022
9
Barst RJ,et al.:N Engl J Med.1996;334:296-301
10
社内資料:海外臨床試験
11
Macdermot J,et al.:Eur J Pharmacol.1981;75:127-130
12
Tateson JE,et al.:Prostaglandins.1977;13:389-397
13
Armstrong JM,et al.:Br J Pharmacol.1978;62:125-130
14
Whittle BJR,et al.:Prostaglandins.1978;16:373-388
15
Perlman MB,et al.:J Appl Physiol.1986;60:546-553
16
Prielipp RC,et al.:Crit Care Med.1991;19:60-67