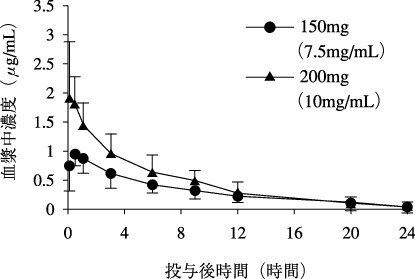
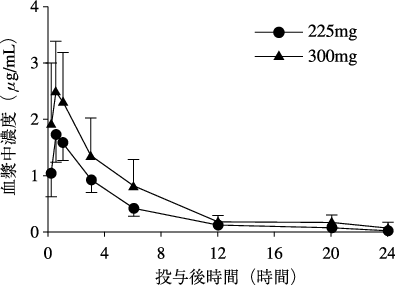
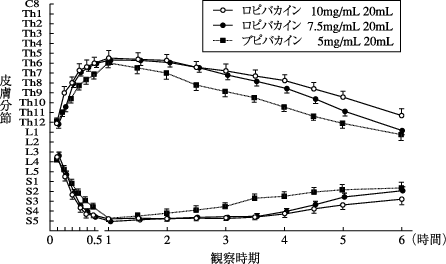
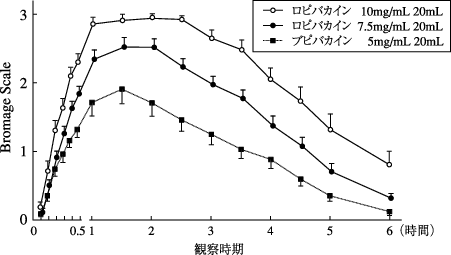
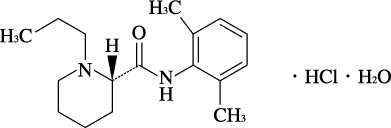
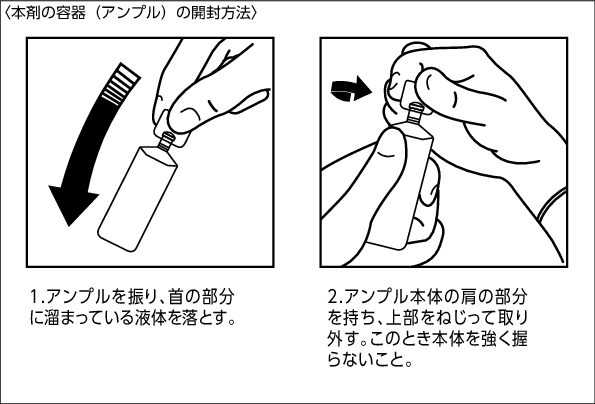
1
大澤正巳ほか:臨床医薬. 1999;15(7):1101-1116
2
大澤正巳ほか:臨床医薬. 1999;15(7):1175-1189
3
山本健ほか:臨床医薬. 1999;15(7):1137-1154
4
Emanuelsson B-M, et al.:Ther Drug Monit. 1997;19:126-131
5
Emanuelsson B-M, et al.:Anesthesiology. 1997;87:1309-1317
6
Lee A, et al.:Anesth Analg. 1989;69:736-738
7
社内資料:蛋白結合及び血球への分布(2001年4月4日承認、申請資料概要ヘ.3.2))
8
Datta S, et al.:Anesthesiology. 1995;82:1346-1352
9
Halldin MM, et al.:Drug Metab Dispos. 1996;24:962-968
10
Ekström G, et al.:Drug Metab Dispos. 1996;24:955-961
11
Arlander E, et al.:Clin Pharmacol Ther. 1998;64:484-491
12
大澤正巳ほか:臨床医薬. 1999;15(7):1205-1228
13
大澤正巳ほか:臨床医薬. 1999;15(7):1273-1287
14
山本健ほか:臨床医薬. 1999;15(7):1191-1204
15
足立健彦:麻酔. 1998;47(増刊):S109-S112
16
Arlock P.:Pharmacol Toxicol. 1988;63:96-104
17
社内資料:イヌ硬膜外麻酔作用(2001年4月4日承認、申請資料概要ホ.Ⅰ.1.2))
18
社内資料:ヒツジ硬膜外麻酔作用(2001年4月4日承認、申請資料概要ホ.Ⅰ.1.3))
19
社内資料:モルモット伝達麻酔作用(2001年4月4日承認、申請資料概要ホ.Ⅰ.1.4))
20
Bader AM, et al.:Anesth Analg. 1989;68:724-727
21
大澤正巳ほか:臨床医薬. 1999;15(7):1229-1252
22
社内資料:ラット痙攣誘発作用(2001年4月4日承認、申請資料概要ホ.Ⅱ.1.1))
23
Feldman HS, et al.:Anesth Analg. 1989;69:794-801
24
Santos AC, et al.:Anesthesiology. 1995;82:734-740
25
Scott DB, et al.:Anesth Analg. 1989;69:563-569
26
Knudsen K, et al.:Br J Anaesth. 1997;78:507-514
27
Hurley RJ, et al.:Reg Anesth. 1991;16:303-308
28
Brockway MS, et al.:Br J Anaesth. 1991;66:31-37