1
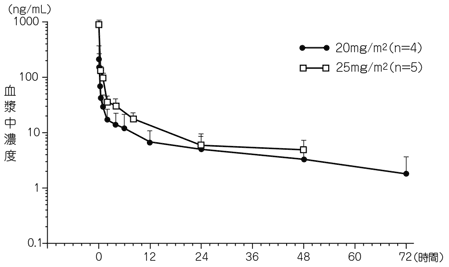
社内資料:国内第Ⅰ相臨床試験におけるKW-2307単回及び反復静脈内投与時の血漿中動態及び尿中排泄
2
Kobayashi S, et al.:Arzneim.-Forsch./Drug Res. 1993; 43: 1367-1377
3
社内資料:ヒト肝ミクロゾームによるKW-2307の代謝酵素の推定及びP-450活性に与える影響
4
F. Jehl, et al.:J. Chromatogr. 1990; 525: 225-233
5
P. Bore, et al.:Cancer Chemother. Pharmacol. 1989; 23: 247-251
6
古瀬清行ほか:癌と化学療法. 1994; 21: 785-793
7
古瀬清行ほか:癌と化学療法. 1994; 21: 1941-1947
8
古瀬清行ほか:癌と化学療法. 1995; 22: 67-76
9
Y. Kusunoki, et al.:Proc. ASCO. 1995; 14: 353(抄録#1071)
10
古瀬清行ほか:新薬と臨床. 1998; 47: 1101-1113
11
M. Toi, et al.:Jpn. J. Clin. Oncol. 2005; 35: 310-315
12
仁井谷久暢ほか:癌と化学療法. 1994; 21: 177-187
13
古瀬清行ほか:新薬と臨床. 1998; 47: 1089-1100
14
冨永健ほか:癌と化学療法. 1994; 21: 801-808
15
冨永健ほか:癌と化学療法. 1994; 21: 809-816
16
T. Tominaga, et al.:17th International Cancer Congress. 1998(抄録#668)
17
冨永健ほか:癌と化学療法. 2005; 32: 983-990
18
T. Saeki, et al.:Breast Cancer. 2006; 13: 159-165
19
S. Binet, et al.:Seminars in Oncology. 1989; 16(Suppl.4): 5-8
20
芦沢忠ほか:癌と化学療法. 1993; 20: 59-66
21
A. Fellous, et al.:Seminars in Oncology. 1989; 16(Suppl.4): 9-14