1
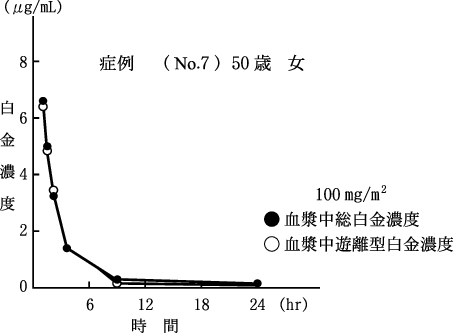
社内資料:癌患者における点滴静注時の白金の体内動態
2
犬山征夫 他:癌と化学療法. 1992;19(6):863-869
3
犬山征夫 他:癌と化学療法. 1992;19(6):871-877
4
古瀬清行 他:癌と化学療法. 1992;19(6):879-884
5
田口鐵男 他:癌と化学療法. 1992;19(4):483-488
6
Akaza H., et al.:Cancer Chemother. Pharmacol. 1992;31:187-192
7
加藤俊 他:癌と化学療法. 1992;19(5):695-701
8
野田起一郎 他:癌と化学療法. 1992;19(6):885-892
9
Fukuda M., et al.:Cancer Chemother. Pharmacol. 1990;26:393-396
10
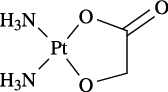
社内資料:白金化合物と核酸の反応特異性に関する検討