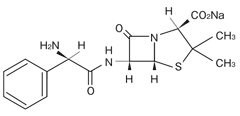
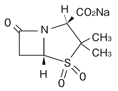
1
Matsuda, S.:Biol Res Pregnancy Perinatol. 1984;5(2):57-60
2
N Engl J Med. 1972;286(10):505-507
3
柴 孝也ほか.:Chemotherapy(Tokyo). 1988;36(Suppl.8):149-159
4
Jpn J Antibiot. 1989;42(3):SULBACTAM/AMPICILLIN特集Iを中心に集計
5
由良 二郎ほか.:Chemotherapy(Tokyo). 1988;36(Suppl.8):324-333
6
林 泉ほか.:Chemotherapy(Tokyo). 1988;36(Suppl.8):120-125
7
菊山 成博ほか.:Chemotherapy(Tokyo). 1988;36(Suppl.8):317-323
8
張南 薫ほか.:Chemotherapy(Tokyo). 1988;36(Suppl.8):466-489
9
関口 隆憲ほか.:Jpn J Antibiot. 1989;42(3):733-742
10
佐藤 吉壮ほか.:Jpn J Antibiot. 1989;42(3):579-593
11
下岡 釿雄ほか.:Chemotherapy(Tokyo). 1988;36(Suppl.8):66-80
12
Blum, R. A. et al.:Antimicrob Agents Chemother. 1989;33(9):1470-1476
13
Wright, N. et al.:J Antimicrob Chemother. 1983;11(6):583-587
14
社内資料:市中肺炎患者における母集団薬物動態(2012年8月10日承認、CTD2.7.2.3.5)[L20120703012]
15
Chemotherapy(Tokyo). 1988;36(Suppl.8):SULBACTAM・AMPICILLIN論文特集号を集計
16
社内資料:市中肺炎に対する注射用スルバクタムナトリウム・アンピシリンナトリウム高用量投与の多施設共同、非盲検、非対照試験(2012年8月10日承認、CTD2.7.3A、2.7.6)[L20120703013]
17
横田 健ほか.:Chemotherapy(Tokyo). 1984;32(Suppl.4):11-19
18
横田 健ほか.:Chemotherapy(Tokyo). 1985;33(Suppl.2):10-22
19
横田 健ほか.:Chemotherapy(Tokyo). 1988;36(Suppl.8):1-12
20
五島 瑳智子ほか.:Chemotherapy(Tokyo). 1988;36(Suppl.8):13-33
21
川崎 賢二ほか.:Chemotherapy(Tokyo). 1988;36(Suppl.8):34-57