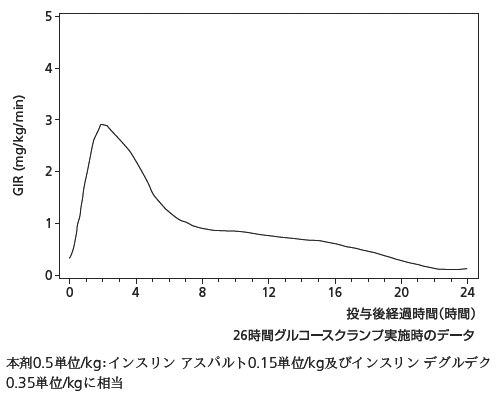
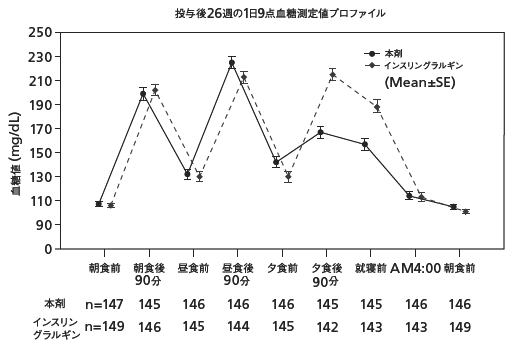
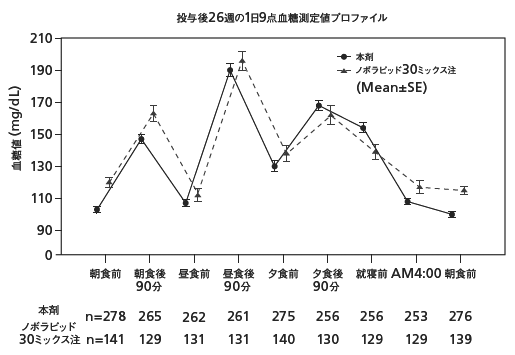
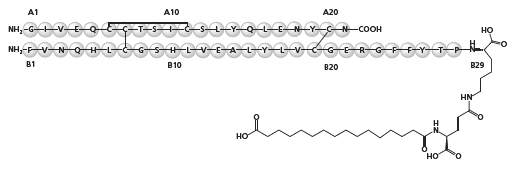
1
Herings RMC, et al.:Lancet. 1995;345:1195-8
2
Haahr H, et al.:J Diabetes Investig. 2016;7:574-80
3
Ikushima I, et al.:J Diabetes Investig. 2016;7:270-5
4
Brunner M. B, et al.:Drugs Aging. 2015;32:583-90
5
Korsatko S, et al.:Drugs Aging. 2014;31:47-53
6
Biester T, et al.:Pediatr Diabetes. 2016;17:642-49
7
Kiss I, et al.:Clin Pharmacokinet. 2014;53:175-83
8
Kupcová V, et al.:Clin Drug Investig. 2014;34:127-33
9
Onishi Y, et al.:Diabetes Obes Metab. 2013;15:826-32
10
Kaneko S, et al.:Diabetes Res Clin Pract. 2015;107:139-47
11
Hirsch I, et al.:Diabetes Care. 2012;35:2174-81
12
Hirsch I, et al.:Diabet Med. 2017;34:167-73
13
Jonassen I, et al.:Pharm Res. 2012;29:2104-14
14
Rhodes CJ, et al.:Eur J Clin Invest. 2002;32:suppl 3:3-13