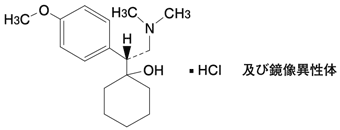
1
社内資料:毒性試験(2015年9月28日承認、CTD2.4.5.3)
2
社内資料:胎児移行性(ウサギ)(GTR-17290)(2015年9月28日承認、CTD2.6.4.4.4)
3
社内資料:乳汁中排泄(ラット)(GTR-17952)(2015年9月28日承認、CTD2.6.4.6.3)
4
Ilett KF, et al.:Br J Clin Pharmacol. 2002;53(1):17-22
5
Emslie GJ, et al.:J Am Acad Child Adolesc Psychiatry. 2007;46(4):479-488
6
Hammad TA, et al.:Arch Gen Psychiatry. 2006;63(3):332-339
7
Harvey AT, et al.:Arch Gen Psychiatry. 2000;57(5):503-509
8
Debonnel G, et al.:Int J Neuropsychopharmacol. 2007;10(1):51-61
9
社内資料:国内第3相試験(B2411263試験)(2015年9月28日承認、CTD2.7.6.35)
10
社内資料:健康成人における単回投与時の薬物動態(156-JA試験)(2015年9月28日承認、CTD2.7.6.8)
11
社内資料:健康成人における反復投与時の薬物動態(153-JA試験)(2015年9月28日承認、CTD2.7.6.9)
12
社内資料:薬物動態における食事の影響(156-JA試験)(2015年9月28日承認、CTD2.7.1.2.4)
13
社内資料:タンパク結合率(in vitro)(2015年9月28日承認、CTD2.7.2.2.1.1)
14
Howell SR, et al.:Xenobiotica. 1993;23(4):349-359
15
社内資料:腎機能障害患者における薬物動態(2015年9月28日承認、CTD2.7.2.3.5)
16
社内資料:肝機能障害患者における薬物動態(2015年9月28日承認、CTD2.7.2.3.6)
17
Preskorn S, et al.:J Clin Psychopharmacol. 2009;29(1):39-43
18
社内資料:ハロペリドールとの薬物相互作用(95-059-MA試験)(2015年9月28日承認、CTD2.7.2.1.2.5.10)
19
Amchin J, et al.:Psychopharmacol Bull. 1998;34(2):211-219
20
社内資料:イミプラミンとの薬物相互作用(129-US試験)(2015年9月28日承認、CTD2.7.2.1.2.5.7)
21
Lindh JD, et al.:Eur J Clin Pharmacol. 2003;59(5-6):401-406
22
Troy SM, et al.:J Clin Pharmacol. 1998;38(5):467-474
23
社内資料:メトプロロールとの薬物相互作用(132-SW試験)(2015年9月28日承認、CTD2.7.2.1.2.5.6)
24
Amchin J, et al.:J Clin Pharmacol. 1999;39(3):297-309
25
Levin GM, et al.:Psychopharmacol Bull. 2001;35(2):62-71
26
Jann MW, et al.:Eur J Clin Pharmacol. 2012;68(5):715-721
27
Troy SM, et al.:J Clin Pharmacol. 1996;36(2):175-181
28
社内資料:カルバマゼピンとの薬物相互作用(133-UK試験)(2015年9月28日承認、CTD2.7.2.2.5.2)
29
Troy SM, et al.:J Clin Pharmacol. 1995;35(4):410-419
30
社内資料:トルブタミドとの薬物相互作用(118-US試験)(2015年9月28日承認、CTD2.7.2.2.5.11)
31
社内資料:長期投与試験(B2411264試験、818-JA試験)(2015年9月28日承認、CTD2.7.6.44)
32
社内資料:ラット脳シナプトソームにおけるモノアミン取り込み阻害作用(2015年9月28日承認、CTD2.6.2.2.1.2)
33
社内資料:ラット大脳前頭皮質における細胞外5-HTおよびNA濃度増加作用(RPT-43824)(2015年9月28日承認、CTD2.6.2.2.2.1)
34
社内資料:尾懸垂試験における無動時間短縮作用(マウス)(RPT-43898)(2015年9月28日承認、CTD2.6.2.2.2.2)
35
社内資料:強制水泳試験における無動時間短縮作用(マウス)(GTR-21946)(2015年9月28日承認、CTD2.6.2.2.2.3)
36
社内資料:学習性無力モデルにおける回避学習改善効果(ラット)(GTR-21948)(2015年9月28日承認、CTD2.6.2.2.2.4)
37
社内資料:居住者・侵入者モデルにおける攻撃行動に対する作用(ラット)(2015年9月28日承認、CTD2.6.2.2.2.5)