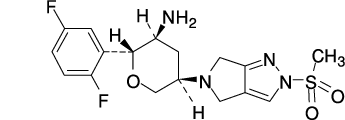
1
Deacon CF, et al. Expert Opin Pharmacother. 2013;14:2047-2058.
2
オマリグリプチンのin vitro及びin vivo薬理試験(2015年9月28日承認、CTD 2.6.2.2)
3
オマリグリプチンの第Ⅱ相臨床試験(2015年9月28日承認、CTD 2.7.6.3.1.3.3)
4
Sheu WH, et al. Diabetes Care. 2015;38:2106-2114.
持続性選択的DPP-4阻害剤◎経口糖尿病用剤◎
1錠 388.9円
有効成分 | オマリグリプチン 12.5mg |
|---|---|
添加剤 | D-マンニトール、結晶セルロース、クロスカルメロースナトリウム、ステアリン酸マグネシウム、カルナウバロウ、ヒプロメロース、ヒドロキシプロピルセルロース、酸化チタン、タルク、黄色三二酸化鉄 |
有効成分 | オマリグリプチン 25mg |
|---|---|
添加剤 | D-マンニトール、結晶セルロース、クロスカルメロースナトリウム、ステアリン酸マグネシウム、カルナウバロウ、ヒプロメロース、ヒドロキシプロピルセルロース、酸化チタン |
| 剤形 | 円形・フィルムコーティング錠 |
|---|---|
| 色調 | 黄色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 5.6mm 大きさ(厚さ) 3.1mm |
| 質量 | 約85mg |
| 識別コード |  781 781 |
| 剤形 | アーモンド形・フィルムコーティング錠 |
|---|---|
| 色調 | 白色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(長径) 9.4mm 大きさ(短径) 5.4mm 大きさ(厚さ) 3.7mm |
| 質量 | 約166mg |
| 識別コード |  782 782 |
腎機能障害 | eGFR(mL/min/1.73m2) 血清クレアチニン値(mg/dL)注) | 投与量 |
重度、末期腎不全 | eGFR<30 男性:Cr>1.9 女性:Cr>1.4 | 12.5mg 週1回 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
糖尿病用薬: インスリン製剤 スルホニルウレア剤 チアゾリジン系薬剤 ビグアナイド系薬剤 α-グルコシダーゼ阻害剤 速効型インスリン分泌促進薬 GLP-1受容体作動薬 SGLT2阻害剤等 | 低血糖の発現に注意すること。特に、インスリン製剤又はスルホニルウレア剤と併用する場合、低血糖のリスクが増加するため、これらの薬剤の減量を検討すること。 | 糖尿病用薬(特に、インスリン製剤又はスルホニルウレア剤)との併用時には、血糖降下作用の増強により、低血糖のリスクが増加するおそれがある。 |
血糖降下作用を増強する薬剤: β-遮断薬 サリチル酸剤 モノアミン酸化酵素阻害剤等 | 左記薬剤と本剤を併用する場合には、血糖値その他患者の状態を十分観察しながら投与すること。 | 左記薬剤との併用により血糖降下作用が増強されるおそれがある。 |
血糖降下作用を減弱する薬剤: アドレナリン 副腎皮質ホルモン 甲状腺ホルモン等 | 左記薬剤と本剤を併用する場合には、血糖値その他患者の状態を十分観察しながら投与すること。 | 左記薬剤との併用により血糖降下作用が減弱されるおそれがある。 |
0.2~1%未満 | |
|---|---|
胃腸障害 | 便秘、下痢 |
皮膚及び皮下組織障害 | 湿疹 |
臨床検査 | ALT増加、グリコヘモグロビン増加、血中ブドウ糖増加 |
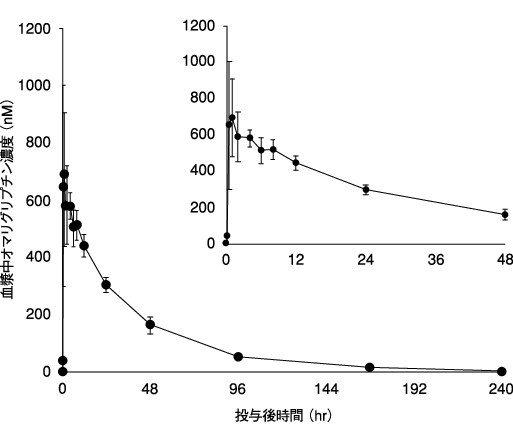
幾何平均 | 95%信頼区間 | |
AUC0-∞(μM・hr) | 25.1 | (22.9, 27.6) |
Cmax(nM) | 750 | (637, 883) |
C168hr(nM) | 20.0 | (15.3, 26.1) |
Tmax注1)(hr) | 1.00 | [0.50, 4.00] |
t1/2注2)(hr) | 38.9 | (25.8)注3) |
投与第1週 | 投与第3週 | |||
幾何平均 | 95%信頼区間 | 幾何平均 | 95%信頼区間 | |
AUC0–168hr(μM・hr) | 21.2 | (18.7, 24.1) | 22.3 | (19.6, 25.3) |
Cmax(nM) | 803 | (654, 985) | 701 | (571, 860) |
C168hr(nM) | 14.8 | (11.2, 19.4) | 16.4 | (12.5, 21.5) |
Tmax注4)(hr) | 0.50 | [0.50, 2.00] | 1.50 | [0.33, 2.17] |
t1/2注5)(hr) | - | - | 82.5 | (53.3)注6) |
腎機能障害の程度 | AUC0-∞注7)(μM・hr) | Cmax注7)(nM) | |
軽度腎機能障害者 (n=6) | 4.70 (4.08, 5.42) | 60.4 (51.8, 70.3) | |
健康成人との比注8) | 0.94(0.80, 1.11) | 0.94(0.79, 1.12) | |
中等度腎機能障害者 (n=6) | 5.79 (4.95, 6.76) | 61.4 (50.6, 74.5) | |
健康成人との比注8) | 1.34(1.12, 1.61) | 1.13(0.91, 1.41) | |
重度腎機能障害者 (n=6) | 6.47 (5.58, 7.50) | 48.7 (37.3, 63.5) | |
健康成人との比注8) | 1.56(1.32, 1.85) | 0.90(0.66, 1.23) | |
末期腎不全患者 (n=6) | 7.59 (5.85, 9.83) | 41.0 (32.3, 52.0) | |
健康成人との比注8) | 1.97(1.46, 2.66) | 0.73(0.56, 0.95) | |
プラセボ | オマリグリプチン | シタグリプチン | |
HbA1c値(%) | |||
投与前からの変化量 | 0.1[-0.0, 0.3] | -0.7[-0.8, -0.6] | -0.6[-0.7, -0.5] |
プラセボとの差 | - | -0.8注1)[-1.0, -0.6] | -0.8注1)[-0.9, -0.6] |
シタグリプチンとの差 | - | -0.0[-0.2, 0.1] | - |
食後2時間血糖値(mg/dL) | |||
投与前からの変化量 | -5[-15, 4] | -42[-50, -35] | -45[-52, -38] |
プラセボとの差 | - | -37注1)[-48, -25] | -40注1)[-51, -28] |
シタグリプチンとの差 | - | 3[-7, 12] | - |
空腹時血糖値(mg/dL) | |||
投与前からの変化量 | -6[-11, -2] | -19[-22, -15] | -21[-24, -17] |
プラセボとの差 | - | -12注1)[-18, -7] | -15注1)[-20, -9] |
シタグリプチンとの差 | - | 2[-2, 7] | - |
HbA1c値(%) | ||
投与前からの変化量 | プラセボとの差 | |
スルホニルウレア剤併用 | ||
プラセボ | 0.1[-0.1, 0.2] | - |
オマリグリプチン | -0.8[-0.9, -0.7] | -0.9注2)[-1.1, -0.7] |
速効型インスリン分泌促進剤併用 | ||
プラセボ | 0.3[-0.0, 0.6] | - |
オマリグリプチン | -0.7[-0.9, -0.5] | -1.0注2)[-1.4, -0.6] |
ビグアナイド系薬剤併用 | ||
プラセボ | -0.0[-0.4, 0.3] | - |
オマリグリプチン | -0.9[-1.1, -0.8] | -0.9注2)[-1.3, -0.6] |
チアゾリジン系薬剤併用 | ||
プラセボ | 0.3[0.0, 0.5] | - |
オマリグリプチン | -0.9[-1.0, -0.7] | -1.2注2)[-1.5, -0.9] |
α-グルコシダーゼ阻害剤併用 | ||
プラセボ | 0.1[-0.2, 0.3] | - |
オマリグリプチン | -0.7[-0.9, -0.6] | -0.8注2)[-1.1, -0.5] |
HbA1c値(%) | |
投与前からの変化量 | |
スルホニルウレア剤併用 | -0.4[-0.6, -0.3] |
速効型インスリン分泌促進剤併用 | -0.6[-0.8, -0.3] |
ビグアナイド系薬剤併用 | -0.6[-0.8, -0.4] |
チアゾリジン系薬剤併用 | -0.6[-0.8, -0.4] |
α-グルコシダーゼ阻害剤併用 | -0.6[-0.8, -0.4] |
HbA1c値(%) | ||
投与前からの変化量 | プラセボとの差 | |
プラセボ | 0.3[0.1, 0.5] | - |
オマリグリプチン | -0.6[-0.7, -0.5] | -0.9注3)[-1.1, -0.7] |