1
Geisser P, et al.:Clin Nephrol.2010;74:4-11.[文献参照番号][83940]
2
社内資料:薬物動態試験:分布(2015年9月28日承認,CTD 2.6.4.1)[文献参照番号][85451]
3
社内資料:薬物動態試験:排泄(2015年9月28日承認,CTD 2.6.4.6)[文献参照番号][85452]
4
社内資料:血液透析患者を対象とした第III相比較臨床試験(2015年9月28日承認,CTD 2.7.6.10)[文献参照番号][85434]
5
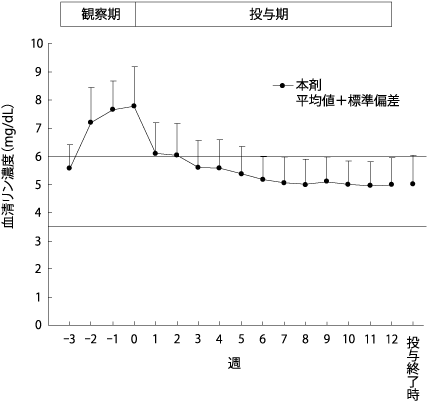
社内資料:血液透析患者を対象とした長期投与試験(2015年9月28日承認,CTD 2.7.6.13)[文献参照番号][85436]
6
社内資料:血液透析患者を対象とした炭酸カルシウムとの併用試験(2015年9月28日承認,CTD 2.7.6.15)[文献参照番号][85438]
7
社内資料:腹膜透析患者を対象とした第III相臨床試験(2015年9月28日承認,CTD 2.7.6.14)[文献参照番号][85440]
8
社内資料:薬理試験(2015年9月28日承認,CTD 2.4.2.1)[文献参照番号][000315]