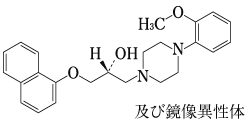
1
中島 光好他:臨床医薬. 1992; 8(Suppl.3): 11-29
2
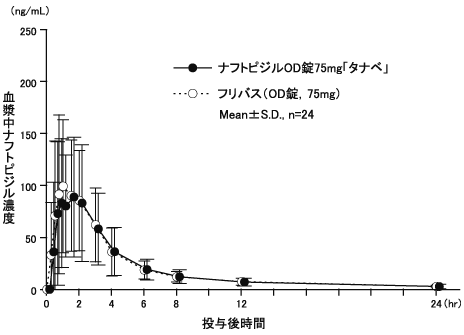
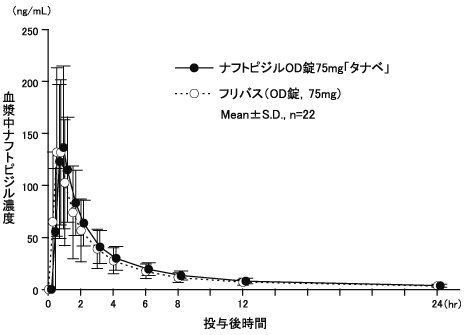
ナフトピジルOD錠の生物学的同等性に関わる資料(社内資料)
3
寺門 敬夫他:臨床医薬. 1992; 8(Suppl.3): 3-9
4
ナフトピジルOD錠の溶出性に関わる資料(社内資料)
5
深谷保男ほか:西日本泌尿器科. 1992;54(5):697-710
6
山口脩ほか:基礎と臨床. 1997;31(3):1315-1360
7
山口脩ほか:臨床医薬. 1992;8(3):699-722
8
山西友典ほか:泌尿器外科. 1992;5(4):359-363
9
第十七改正日本薬局方解説書 廣川書店 2016:C3640-C3643
10
Yamada,S.,et al.:Life Sci. 1992; 50(2): 127-135
11
山中 直人他:泌尿器科紀要. 1991; 37: 1759-1772
12
Yasuda,K.,et al.:Prostate. 1994; 25: 46-52
13
森 龍太郎他:薬理と治療. 1992; 20(2): 375-381
14
Takei,R.,et al.:Jpn.J.Pharmacol. 1999; 79: 447-454