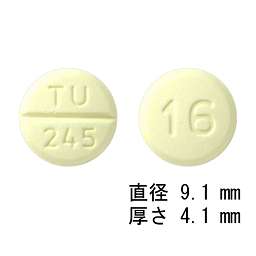
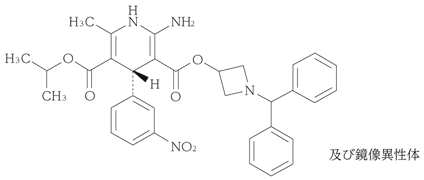
1
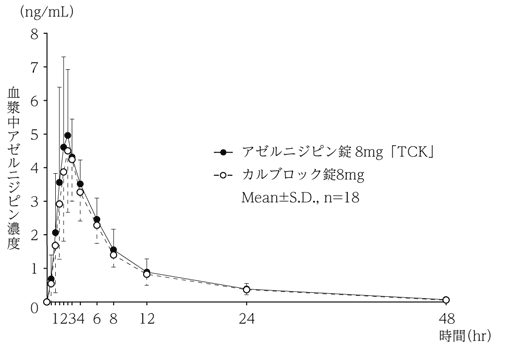
社内資料:生物学的同等性試験(錠8mg)
2
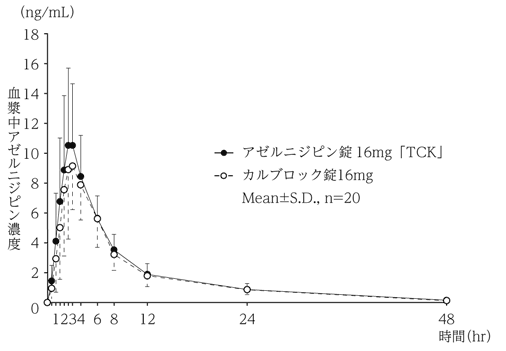
社内資料:生物学的同等性試験(錠16mg)
3
チトクロームP450分子種(カルブロック錠:2003年1月31日承認、申請資料概要 ヘ-Ⅱ-3)
4
代謝に及ぼすグレープフルーツジュースの影響(カルブロック錠:2003年1月31日承認、申請資料概要 ヘ-Ⅱ-5)
5
イトラコナゾール併用投与時の薬物動態(カルブロック錠:2003年1月31日承認、申請資料概要 ヘ-Ⅲ-6)
6
シンバスタチン併用投与時の薬物動態(カルブロック錠:2003年1月31日承認、申請資料概要 ヘ-Ⅲ-6)
7
アトルバスタチン及びプラバスタチン併用投与時の薬物動態(カルブロック錠:2012年12月19日、再審査報告書)
8
Hirashima H, et al.:臨床薬理 2006;37(3):127-133
9
アゼルニジピンの作用機序(カルブロック錠:2003年1月31日承認、申請資料概要 ホ-Ⅰ-2)
10
アゼルニジピンの初回通過効果(カルブロック錠:2003年1月31日承認、申請資料概要 ヘ-Ⅱ-1)