添付文書番号
2190406G1058_1_04
企業コード
480235
作成又は改訂年月
日本標準商品分類番号
87219
薬効分類名
プロスタグランジンE1製剤
承認等
販売名
アルプロスタジル注5μgシリンジ「トーワ」
販売名コード
販売名英字表記
ALPROSTADIL INJECTION 5μg SYRINGE “TOWA”
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
一般的名称
アルプロスタジル注射液
警告
〈動脈管依存性先天性心疾患〉
本剤投与により無呼吸発作が発現することがあるので、呼吸管理設備の整っている施設で投与すること。
禁忌(次の患者には投与しないこと)
重篤な心不全の患者
出血(頭蓋内出血、消化管出血、喀血等)している患者
妊婦又は妊娠している可能性のある女性
本剤の成分に対し過敏症の既往歴のある患者
組成・性状
組成
アルプロスタジル注5μgシリンジ「トーワ」
有効成分 | 1シリンジ(1mL)中 |
|---|
有効成分 | 日局 アルプロスタジル… 5μg |
|---|
添加剤 | 精製ダイズ油…100mg
高度精製卵黄レシチン…18mg
オレイン酸…2.4mg
濃グリセリン…22.1mg
pH調節剤(塩酸、水酸化ナトリウム)…適量 |
|---|
製剤の性状
アルプロスタジル注5μgシリンジ「トーワ」
| 剤形 | 乳濁液で、わずかに粘性があり、特異なにおいがある。 |
|---|
| 色調 | 白色 |
|---|
| pH | 4.5~6.0 |
|---|
| 浸透圧比 | 約1(生理食塩液に対する比) |
|---|
効能又は効果
〇慢性動脈閉塞症(バージャー病、閉塞性動脈硬化症)における四肢潰瘍ならびに安静時疼痛の改善
〇下記疾患における皮膚潰瘍の改善
進行性全身性硬化症
全身性エリテマトーデス
〇糖尿病における皮膚潰瘍の改善
〇振動病における末梢血行障害に伴う自覚症状の改善ならびに末梢循環・神経・運動機能障害の回復
〇動脈管依存性先天性心疾患における動脈管の開存
〇経上腸間膜動脈性門脈造影における造影能の改善
用法及び用量
〈慢性動脈閉塞症(バージャー病、閉塞性動脈硬化症)、進行性全身性硬化症、全身性エリテマトーデス、糖尿病、振動病〉
通常、成人1日1回1~2mL(アルプロスタジルとして5~10μg)をそのまま又は輸液に混和して緩徐に静注、又は点滴静注する。
なお、症状により適宜増減する。
〈動脈管依存性先天性心疾患の場合〉
輸液に混和し、開始時アルプロスタジル5ng/kg/minとして持続静注し、その後は症状に応じて適宜増減して有効最小量とする。
〈経上腸間膜動脈性門脈造影における造影能の改善〉
通常、成人には1回1mL(アルプロスタジルとして5μg)を生理食塩液で10mLに希釈し、造影剤注入30秒前に3~5秒間で経カテーテル的に上腸間膜動脈内に投与する。
重要な基本的注意
〈慢性動脈閉塞症(バージャー病、閉塞性動脈硬化症)、進行性全身性硬化症、全身性エリテマトーデス、振動病、糖尿病における皮膚潰瘍〉
本剤による治療は対症療法であり、投与中止後再燃することがあるので注意すること。
心不全、肺水腫、胸水があらわれることがあるので、循環状態(血圧、脈拍等)を十分に観察すること。特に高齢者は心機能等生理機能が低下しているので、患者の状態を観察しながら慎重に投与すること。
〈糖尿病における皮膚潰瘍〉
糖尿病治療の基本である食事療法、運動療法、経口血糖降下剤、インスリン等の治療を行った上での適用を考慮すること。
外用の糖尿病性潰瘍治療剤では十分な効果が期待されない患者に対して適用を考慮すること。
投与中は経過を十分に観察し、4週間連日投与して効果が認められない場合には、他の適切な治療に切り替えること。
〈経上腸間膜動脈性門脈造影〉
肝硬変がある場合には、十分な造影能が得られない可能性がある。
特定の背景を有する患者に関する注意
合併症・既往歴等のある患者
心不全の患者(重篤な心不全の患者を除く)
心不全の増強傾向があらわれることがある。
緑内障、眼圧亢進のある患者
眼圧を亢進させるおそれがある。
胃潰瘍の合併又はその既往歴のある患者
既往のある患者に胃出血をおこすおそれがある。
間質性肺炎の患者
間質性肺炎を増悪することがある。
出血傾向のある患者
出血を助長するおそれがある。
〈経上腸間膜動脈性門脈造影〉
重度の食道静脈瘤が認められている患者
門脈圧を上昇させるおそれがある。
腎機能障害患者
妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験(ラット、in vitro)で子宮収縮作用が報告されている。
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中へ移行することが報告されている。
小児等
動脈管依存性先天性心疾患以外の小児等を対象とした臨床試験は実施していない。
〈動脈管依存性先天性心疾患〉
新生児に投与する場合は、以下の事項を考慮すること。
呼吸管理設備の整っている施設で投与すること。本剤投与により無呼吸発作が発現することがある。
重篤な疾患を有する新生児への投与なので、観察を十分に行い慎重に投与すること。なお、副作用が発現した場合は、投与中止、注入速度の減速など適切な処置を講ずること。
有効最小量で維持すること。過量投与により副作用発現率が高まるおそれがある。
観察を十分に行い、必要以上の長期投与は避けること。長期投与により長管骨膜に肥厚がみられるとの報告がある。
高齢者
減量するなど注意すること。一般に生理機能が低下している。
相互作用
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
抗凝血剤 ワルファリンカリウム等 | 出血傾向の増強をきたすおそれがある。 | 本剤は血小板凝集抑制作用を有するため、これらの薬剤との併用によりその作用を増強するおそれがある。 |
血小板機能を抑制する薬剤 アスピリン
チクロピジン塩酸塩
シロスタゾール等 | 出血傾向の増強をきたすおそれがある。 | 本剤は血小板凝集抑制作用を有するため、これらの薬剤との併用によりその作用を増強するおそれがある。 |
血栓溶解剤 ウロキナーゼ等 | 出血傾向の増強をきたすおそれがある。 | 本剤は血小板凝集抑制作用を有するため、これらの薬剤との併用によりその作用を増強するおそれがある。 |
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
ショック、アナフィラキシー(いずれも頻度不明)
蕁麻疹、喉頭浮腫、呼吸困難、チアノーゼ、血圧低下等が認められた場合には投与を中止し、適切な処置を行うこと。
意識消失(頻度不明)
血圧低下に伴い一過性の意識消失があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
心不全、肺水腫(いずれも頻度不明)
心不全(増強を含む)、肺水腫、胸水があらわれることがあるので、動悸、胸苦しさ、呼吸困難、浮腫等が認められた場合には投与を中止し、適切な処置を行うこと。
間質性肺炎(頻度不明)
間質性肺炎(増悪を含む)があらわれることがあるので、発熱、咳嗽、呼吸困難、胸部X線異常等が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
心筋梗塞(頻度不明)
胸痛、胸部圧迫感、心電図異常等が認められた場合には投与を中止し、適切な処置を行うこと。
脳出血、消化管出血(いずれも頻度不明)
無顆粒球症、白血球減少、血小板減少(いずれも頻度不明)
肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、Al-P、γ-GTP等の上昇を伴う肝機能障害や黄疸があらわれることがある。
無呼吸発作(12.2%)
新生児に投与した場合、無呼吸発作があらわれることがあるので、観察を十分に行うこと。なお、発現した場合は、減量、注入速度の減速、投与中止など適切な処置を行うこと。
その他の副作用
| 0.1~1%未満 | 0.1%未満 | 頻度不明 |
|---|
消化器 | 嘔気
腹痛
嘔吐
下痢
腹部膨満感・不快感 | 食欲不振
便秘
口腔腫脹感 | 口内炎(アフタを含む) |
|---|
循環器 | 血圧降下注)
血管炎
顔面潮紅
胸部絞扼感注) | 発赤
胸痛注)
動悸
頻脈 | 血圧上昇注) |
|---|
呼吸器 | | | 咳嗽
呼吸困難
喘息注) |
|---|
血液 | | 好酸球増多 | |
|---|
中枢神経系 | 発熱
頭痛 | めまい
倦怠感
しびれ(感) | 悪寒
振戦
痙攣 |
|---|
皮膚 | 発疹
そう痒感 | 蕁麻疹 | 発汗 |
|---|
腎臓 | | | 腎不全の増悪注) |
|---|
注射部位 | 血管痛
発赤 | こわばり
そう痒感 | |
|---|
出血傾向注) | | | 出血(鼻出血、眼底出血、結膜出血、皮下出血、血尿等) |
|---|
その他 | 熱感 | 四肢疼痛
(増強を含む)
気分不良
浮腫
視力低下
脱毛 | 低ナトリウム血症
四肢腫脹 |
|---|
注)このような症状があらわれた場合には投与を中止すること
新生児への投与にあたっては、上記の副作用のほか、低クロール血症(1.3%)、低カルシウム血症(0.5%)、高脂血症(0.2%)があらわれることがあるので観察を十分に行うこと。
発現頻度は承認時の国内臨床試験及び製造販売後の使用成績調査の結果を合わせて算出した。
適用上の注意
全般的な注意
次の場合には使用しないこと
薬剤調製時の注意
〈効能共通〉
製品の品質を保持するため、使用直前まで開封しないこと。使用に際しては開封口からゆっくり開けること。
先端のゴム栓を外した後、シリンジ先端部には触れないこと。
輸液に混和する場合は、シリンジで直接輸液を吸引しないこと。
本剤を輸液以外の他の薬剤と混和使用しないこと。ただし血漿増量剤(デキストラン、ゼラチン製剤等)との混和は避けること。
本剤を輸液に混和し使用する場合は混和後24時間以内に使用し残液は廃棄すること。
ポリ塩化ビニル製の輸液セット等を使用した場合、可塑剤であるDEHP[di-(2-ethylhexyl)phthalate:フタル酸ジ-(2-エチルヘキシル)]が製剤中に溶出することが報告されている。
〈動脈管依存性先天性心疾患〉
新生児への投与に際しては、持続静注によりDEHPの総溶出量が増加するので、ポリ塩化ビニル製の輸液セット等の使用を避けることが望ましい。
〈経上腸間膜動脈性門脈造影〉
凝集・クリーミングを起こす可能性があるため、造影剤と直接混和しないこと。また、本剤を投与した後、カテーテル内を生理食塩液で洗浄してから造影剤を投与すること。
薬剤投与時の注意
〈効能共通〉
本剤投与により副作用があらわれた場合には、投与の中止、投与速度の変更など適切な処置を講ずること。
持続投与を行う場合には、ライン内での凝集を防ぐため、必ず単独ラインで投与すること。
本剤は脂肪乳剤を含有しているため、ポリカーボネート製の延長チューブ等を使用した場合、そのコネクター部分にひび割れが発生し、血液及び薬液漏れ、空気混入等の可能性があるので注意すること。
〈経上腸間膜動脈性門脈造影〉
イヌにアルプロスタジル(PGE1)として0.1~1.0μg/kgを前腸間膜動脈内投与したところ、投与1分以後に腸管運動が促進された。この腸管運動の促進が血管造影に影響を与える可能性が否定できないため、経上腸間膜動脈性門脈造影に適用する場合、本剤を造影剤注入30秒前に投与すること。
薬剤投与後の注意
開封後の使用は一回限りとし、使用後の残液は容器とともに速やかに廃棄すること。
その他の注意
臨床使用に基づく情報
本剤の投与により脳梗塞がみられたとの報告がある。
薬効薬理
生物学的同等性試験
血小板凝集に対する作用
アルプロスタジル注10μgシリンジ「トーワ」※及びリプルキット注10μgについて、全血血小板凝集能測定装置を用いてヒト全血での血小板凝集能を測定し、50%凝集圧を誘導するのに必要なコラーゲン濃度を比較検討したところ、血小板凝集抑制作用を示し、両剤の作用は生物学的に同等と判断された。
総頸動脈血流量及び血圧に対する作用
アルプロスタジル注10μgシリンジ「トーワ」※及びリプルキット注10μg(0.1μg/kg)を麻酔下で正常イヌ(1群26匹)に右大腿静脈より投与し、総頸動脈における最大血流変化量及び平均血圧の最大降下量を比較検討したところ、両剤とも血流増加及び血圧降下作用を示し、それぞれの作用は生物学的に同等と判断された。
末梢血流量及び血圧に対する作用
アルプロスタジル注10μgシリンジ「トーワ」※及びリプルキット注10μg(3μg/kg)をストレプトゾトシン(STZ)誘発糖尿病ラット(1群15匹)に尾静脈より投与し、後肢足蹠皮下における最大血流変化量及び平均血圧の最大降下量を比較検討したところ、両剤とも血流増加及び血圧降下作用を示し、それぞれの作用は生物学的に同等と判断された。
※アルプロスタジル注5μgシリンジ「トーワ」はアルプロスタジル注10μgシリンジ「トーワ」の容れ目違いである。
有効成分に関する理化学的知見
一般的名称
アルプロスタジル(Alprostadil)
化学名
7-{(1R,2R,3R)-3-Hydroxy-2-[(1E,3S)-3-hydroxyoct-1-en-1-yl]-5-oxocyclopentyl}heptanoic acid
分子式
C20H34O5
分子量
354.48
性状
白色の結晶又は結晶性の粉末である。エタノール(99.5)又はテトラヒドロフランに溶けやすく、アセトニトリルに溶けにくく、水にほとんど溶けない。
化学構造式
融点
114~118℃
取扱い上の注意
凍結を避けて保存すること。
遮光を保つため、外箱に入れた状態で保存すること。外箱開封後は遮光して保存すること。
包装
主要文献
1
社内資料:薬力学的試験(血小板凝集に対する作用)
2
社内資料:薬力学的試験(総頸動脈血流量及び血圧に対する作用)
3
社内資料:薬力学的試験(末梢血流量及び血圧に対する作用)
文献請求先及び問い合わせ先
〒570-0081 大阪府守口市日吉町2丁目5番15号
製造販売業者等
〈アルプロスタジル注5μgシリンジ「トーワ」使用方法〉
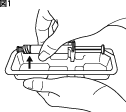
1.ブリスター包装を開封し、製品を取り出してください。
注意)シリンジ(外筒)を持って取り外してください。(図1)
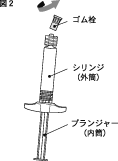
2.ゴム栓部が上になるように立てて、ゴム栓をゆっくり、ななめ方向に倒すように回しながら引き抜いてください。(図2)
3.ゴム栓を外したら速やかに注射針等をセットし、空気を除去して使用してください。
 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379