1
Shirao K, et al.:Jpn J Clin Oncol. 2006;36:295-300.
2
Boku N, et al.:Jpn J Clin Oncol. 2007;37:440-445.
3
Yamada Y, et al.:Jpn J Clin Oncol. 2006;36:218-223.
4
米国添付文書
5
社内資料:進行・再発の結腸・直腸癌の本剤とレボホリナート及びフルオロウラシルの静脈内持続投与法との併用療法に関する資料
6
Larzillière I, et al.:Am J Gastroenterol. 1999;94:3387-3388.
7
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:オキサリプラチン(切除不能進行・再発胃癌)
8
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:オキサリプラチン(小腸癌)
9
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:オキサリプラチン(治癒切除不能な進行・再発の胃癌)
10
社内資料:遺伝毒性試験
11
社内資料:生殖毒性試験
12
社内資料:ラット乳汁移行試験
13
André T, et al.:N Engl J Med. 2004;350:2343-2351.
14
André T, et al.:J Clin Oncol. 2009;27:3109-3116.
15
社内資料:サル心毒性に関する試験
16
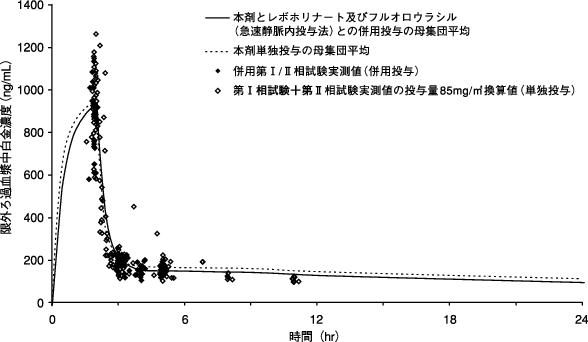
社内資料:薬物動態(母集団薬物動態解析)
17
社内資料:ラット組織分布試験
18
Graham MA, et al.:Clin Cancer Res. 2000;6:1205-1218.
19
社内資料:外国成人癌患者を対象とした臨床薬理試験
20
Takimoto CH, et al.:J Clin Oncol. 2003;21:2664-2672.
21
Doi T, et al.:Jpn J Clin Oncol. 2010;40:913-920.
22
Goldberg RM, et al.:J Clin Oncol. 2004;22:23-30.
23
de Gramont A, et al.:J Clin Oncol. 2000;18:2938-2947.
24
Rothenberg ML, et al.:J Clin Oncol. 2003;21:2059-2069.
25
社内資料:化学療法未治療例を対象とした第Ⅲ相臨床試験
26
社内資料:化学療法既治療例を対象とした第Ⅲ相臨床試験
27
Haller DG, et al.:J Clin Oncol. 2011;29:1465-1471.
28
Okusaka T, et al.:Cancer Sci. 2014;105:1321-1326.
29
Conroy T, et al.:N Engl J Med. 2011;364:1817-1825.
30
社内資料:膵癌FOLFIRINOX法に関する資料
31
Bang YJ, et al.:Lancet. 2012;379:315-321.
32
Noh SH, et al.:Lancet Oncol. 2014;15:1389-1396.
33
社内資料:In vitro薬効薬理試験
34
社内資料:In vivo薬効薬理試験