1
社内資料:生殖発生毒性試験(2012年6月29日、CTD 2.6.6.6)[CRM-0037]
2
社内資料:ラット胎児動脈管に及ぼす影響(2012年6月29日、CTD 2.6.6.8.4)[CRM-0038]
3
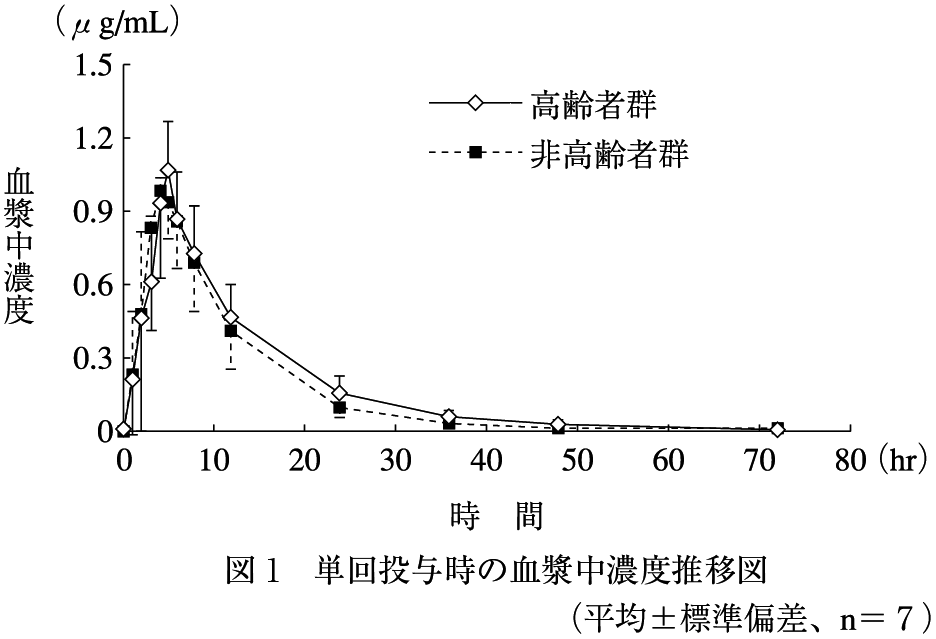
社内資料:高齢者における薬物動態(2012年6月29日、CTD 2.7.6.4)[CRM-0059]
4
社内資料:in vitro蛋白結合の検討(2012年6月29日、CTD 2.6.6.4.2及び2.7.2.2.1)[CRM-0042]
5
社内資料:代謝物の薬理作用(2012年6月29日、CTD 2.6.4.5及び2.6.6.2.8)[CRM-0043]
6
Hara M. et al. : Mod. Rheumatol.,2007;17:1-9[CRM-0003]
7
Hara M. et al. : Mod. Rheumatol.,2007;17:10-17[CRM-0004]
8
浦田紀子ら:薬理と治療,2007;35(6):571-582[CRM-0007]
9
Tanaka K. et al. : Int. J. Immunother.,1993;9(2):69-78[CRM-0033]
10
Aikawa Y. et al. : J. Neuroimmunol.,1998;89:35-42[CRM-0013]
11
社内資料:マウス遅延型足蹠浮腫反応に対する抑制効果(2012年6月29日、CTD 2.6.2.2.7.1)[CRM-0044]
12
山本哲也ら:薬理と治療,2007;35(6):561-569[CRM-0006]
13
Tanaka K. et al. : Rheumatology,2003;42(11):1365-1371[CRM-0020]
14
山本真理ら:薬理と治療,2007;35(6):551-559[CRM-0005]