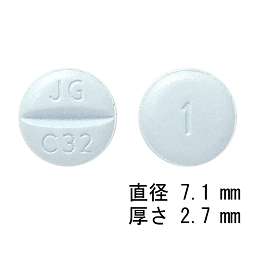
1
深沢英雄 他:臨床薬理 1978;9(3):251-265
2
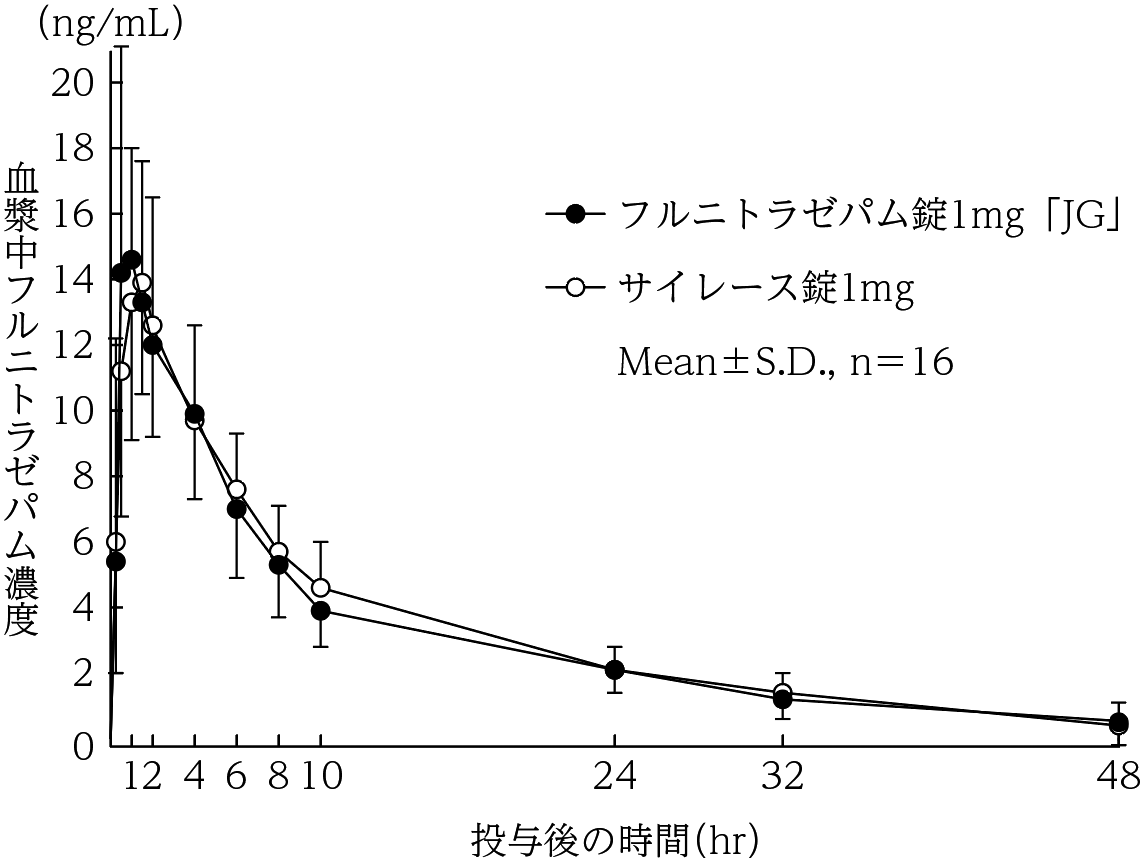
社内資料:生物学的同等性試験(錠1mg)
3
社内資料:生物学的同等性試験(錠2mg)
4
伊藤斉 他:臨床評価 1981;9(3):733-767
5
木村政資 他:医学のあゆみ 1982;120(6):702-719
6
山村秀夫 他:臨牀と研究 1981;58(8):2677-2686
7
岡田敏一:神経精神薬理 1980;2(1):5-16
8
矢島孝 他:応用薬理 1981;21(1):123-142
9
小鳥居湛 他:臨床精神医学 1980;9(5):621-628