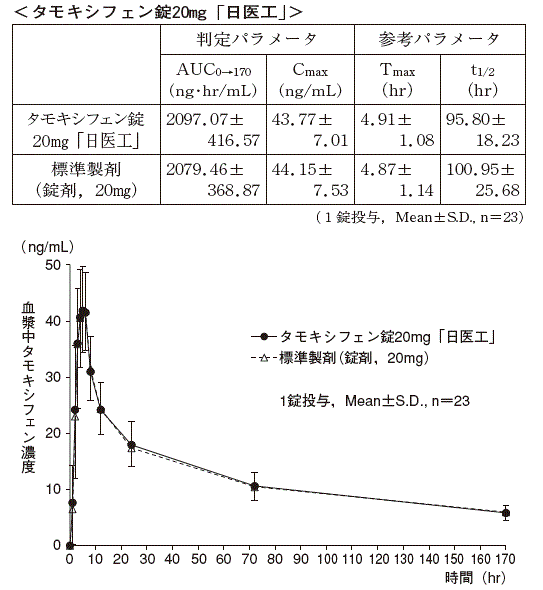
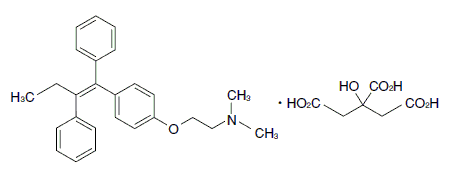
抗乳癌剤
1錠 34.2円
| 剤形・色調 | 白色の素錠 |
|---|---|
| 外形 表面 |  質量:120mg |
| 外形 裏面 |  直径:7.0mm |
| 外形 側面 |  厚さ:3.0mm |
| 本体コード |  220 22010 |
| 包装コード |  220 220 |
| 剤形・色調 | 白色のフィルムコーティング錠 |
|---|---|
| 外形 表面 | 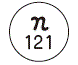 質量:361.9mg |
| 外形 裏面 |  直径:10.0mm |
| 外形 側面 |  厚さ:4.3mm |
| 本体コード | 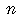 121 12120 |
| 包装コード | 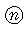 121 121 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| クマリン系抗凝血剤 ワルファリン等 | 抗凝血作用が増強することがあるので,抗凝血剤を減量するなど,慎重に投与すること。 | タモキシフェンがワルファリンの肝臓での代謝を阻害する可能性が考えられている。 |
| リトナビル | 本剤のAUCが上昇することが予想される。 | リトナビルのチトクロームP-450に対する競合的阻害作用により,本剤のAUCが上昇することが予想される。 |
| リファンピシン | 本剤の血中濃度が低下したとの報告がある。 | リファンピシンにより,CYP3A4が誘導され,本剤の代謝が促進される可能性がある。 |
| 選択的セロトニン再取り込み阻害剤(SSRI) パロキセチン等 | 本剤の作用が減弱するおそれがある。併用により乳癌による死亡リスクが増加したとの報告がある。 | CYP2D6阻害作用により本剤の活性代謝物の血漿中濃度が低下したとの報告がある。 |
| 頻度不明 | |
| 肝臓 | 肝機能異常,脂肪肝(非アルコール性脂肪性肝炎を含む) |
| 生殖器 | 無月経,月経異常,性器出血,腟分泌物,卵巣嚢腫,卵巣嚢胞,陰部そう痒,子宮頸管ポリープ,腟ポリープ |
| 消化器 | 悪心・嘔吐,食欲不振,下痢,腹痛等 |
| 精神神経系 | 頭痛,眩暈・めまい,不眠,抑うつ状態,感覚異常(錯感覚,味覚異常を含む) |
| 皮膚 | 発疹,発汗,脱毛,皮膚血管炎,皮膚エリテマトーデス,晩発性皮膚ポルフィリン症,放射線照射リコール反応等 |
| 筋・骨格系 | 筋肉痛 |
| その他 | ほてり・潮紅,体重増加,浮腫,骨痛,腫瘍部の疼痛・発赤,倦怠感,疲労,頻尿,高トリグリセライド血症,下肢痙攣 |