1
社内資料:カニクイザル出生前及び出生後の発生並びに母体の機能に関する試験(2011年7月1日承認、CTD2.6.6.1)
2
社内資料:海外臨床試験における悪性腫瘍の発現頻度(2017年3月30日承認、CTD2.7.4.2)
3
Ling J, et al.:J Clin Pharmacol. 2010; 50: 792-802
4
社内資料:第Ⅰ相臨床試験成績(CNTO148NAP1001)(2011年7月1日承認、CTD2.7.2.2)
5
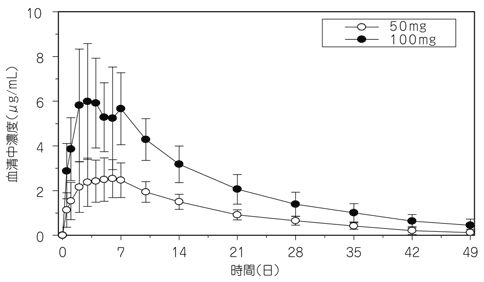
Xu Z, et al.:J Clin Pharmacol. 2010; 50: 276-284
6
Tabrizi MA, et al.:Drug Discov Today. 2006; 11: 81-88
7
社内資料:本川英範, 他:国内第Ⅱ/Ⅲ相臨床試験成績24週(JNS012-JPN-03)(2011年7月1日承認、CTD2.7.3.3)
8
社内資料:本川英範, 他:国内第Ⅱ/Ⅲ相臨床試験成績52週(JNS012-JPN-03)(2011年7月1日承認、CTD2.7.6.12)
9
社内資料:本川英範, 他:国内第Ⅱ/Ⅲ相臨床試験成績16週(JNS012-JPN-04)(2011年7月1日承認、CTD2.7.6.7)
10
社内資料:本川英範, 他:国内第Ⅱ/Ⅲ相臨床試験成績52週(JNS012-JPN-04)(2011年7月1日承認、CTD2.7.6.13)
11
Keystone EC, et al.:Ann Rheum Dis. 2009; 68: 789-796
12
社内資料:第Ⅱ/Ⅲ相臨床試験成績(C0524T17)(2017年3月30日承認、CTD2.5.4.4)
13
社内資料:第Ⅲ相臨床試験成績54週(C0524T18)(2017年3月30日承認、CTD2.5.4.4)
14
社内資料:国内第Ⅲ相臨床試験成績(CNTO148UCO3001)(2017年3月30日承認、CTD2.5.4.4)
15
社内資料:ゴリムマブのTNFαへの結合(2011年7月1日承認、CTD2.6.2.1)
16
社内資料:ゴリムマブのTNFα結合を介した作用(2011年7月1日承認、CTD2.6.2.1)
17
社内資料:TNFαトランスジェニックマウスの実験的関節炎に対するゴリムマブの効果(2011年7月1日承認、CTD2.6.2.1)