1
Fisher, B. et al.:J. Natl. Cancer Inst., 1994;86(7):527-537
2
Wickerham, D. L. et al.:J. Clin. Oncol., 2002;20(11):2758-2760
3
Lahti, E. et al.:Obestet. Gynecol., 1993;81(5):660-664
4
Neven, P. et al.:Lancet, 1989;1:375-376
5
Ismail, S. M. et al.:Histopathology, 1997;30(2):187-191
6
和田富雄他:薬理と治療, 1980;8(2):415-422
7
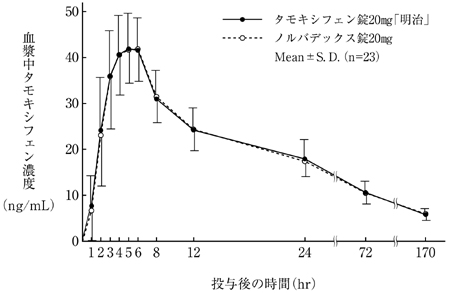
社内資料:生物学的同等性試験
8
Adam, H. K. et al.:Biochem. Pharmacol., 1979;27:145-147
9
Wilkinson, P. et al.:Cancer Chemother. Pharmacol., 1980;5(2):109-111
10
Jacolot, F. et al.:Biochem. Pharmacol., 1991;41(12):1911-1919
11
Stearns, V. et al.:J. Natl. Cancer Inst., 2003;95(23):1758-1764
12
Fromson, J. M. et al.:Xenobiotica, 1973;3(11):711-714
13
第十八改正日本薬局方解説書, 廣川書店, 2021;C-3098-3101
14
The ATAC(Arimidex, Tamoxifen Alone or in Combination)Trialists' Group:Cancer, 2003;98(9):1802-1810
15
The ATAC(Arimidex, Tamoxifen Alone or in Combination)Trialists' Group:Lancet, 2002;359(9324): 2131-2139
16
久保田哲朗他:癌と化学療法, 1980;7(2):257-264
17
Jordan, V. C.:Eur. J. Cancer, 1976;12(6):419-424
18
Tanaka, M. et al.:Jpn. J. Clin. Oncol., 1978;8(2):141-148
19
斉藤一史他:薬理と治療, 1979;7(8):2305-2310
20
Patterson, J. et al.:Breast Cancer Res. Treat., 1982;2:363-374