1
荻原定彦 他:薬理と治療 1992;20(Suppl. 7):S1905-S1924
2
舘田智昭 他:薬理と治療 1992;20(Suppl. 7):S1925-S1943
3
和田重次 他:薬理と治療 1992;20(Suppl. 7):S1975-S1988
4
松本一 他:薬理と治療 2000;28(4):253-258
5
石井當男 他:薬理と治療 1993;21(Suppl. 1):S7-S22
6
石井當男 他:薬理と治療 1993;21(Suppl. 1):S43-S52
7
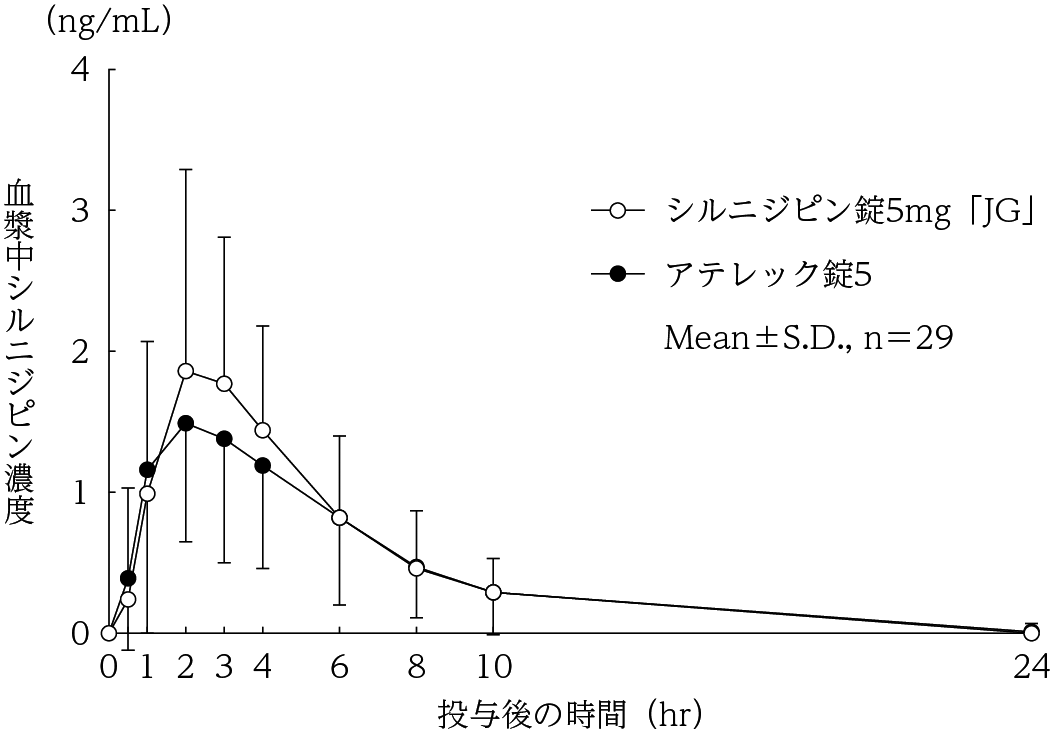
社内資料:生物学的同等性試験(錠5mg)
8
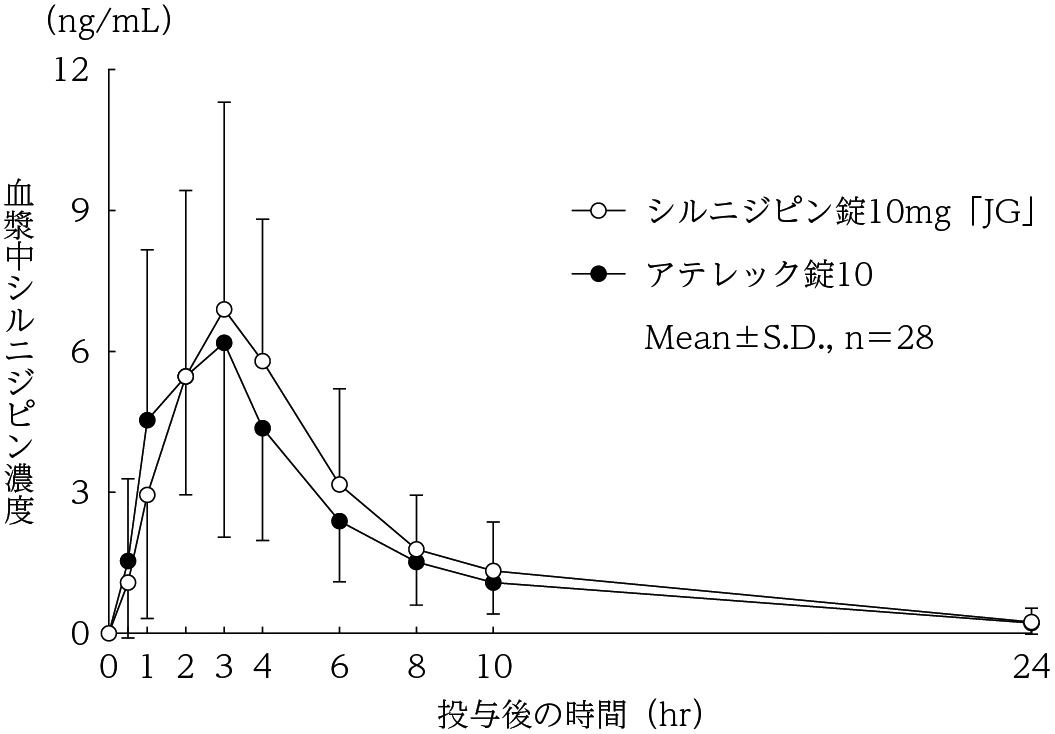
社内資料:生物学的同等性試験(錠10mg)
9
第十八改正 日本薬局方解説書 廣川書店 2021;C2460-C2469
10
石井當男 他:薬理と治療 1993;21(Suppl. 1):S23-S41
11
久慈直光 他:薬理と治療 1993;21(Suppl. 1):S193-S205
12
社内資料:生物学的同等性試験(錠20mg)
13
石井當男 他:薬理と治療 1993;21(1):59-97
14
冨永光裕 他:臨牀と研究 1992;69(10):3321-3326
15
石井當男 他:薬理と治療 1993;21(Suppl. 1):S91-S121
16
石井當男 他:薬理と治療 1993;21(Suppl. 1):S123-S153
17
猿田享男 他:薬理と治療 1993;21(Suppl. 1):S171-S191
18
飯村攻 他:薬理と治療 1993;21(Suppl. 1):S155-S170
19
石井當男 他:薬理と治療 1993;21(Suppl. 1):S65-S77
20
石井當男 他:薬理と治療 1993;21(Suppl. 1):S53-S64
21
石井當男 他:薬理と治療 1993;21(Suppl. 1):S79-S90
22
堀内至 他:薬理と治療 1993;21(Suppl. 1):S233-S245
23
Oike, M. et al.:Circ. Res. 1990;67(4):993-1006
24
Hosono, M. et al.:J. Pharmacobio-Dyn. 1992;15:547-553
25
Fujii, S. et al.:J. Pharmacol. Exp. Ther. 1997;280(3):1184-1191
26
細野昌宏 他:薬理と治療 1995;23(11):3029-3040
27
南順一 他:Therapeutic Research. 1998;19(1):45-49
28
Hosono, M. et al.:Jpn. J. Pharmacol. 1995;69(2):119-125
29
細野昌宏 他:薬理と治療 1995;23(12):3187-3191
30
栽原伸一郎 他:薬理と治療 1993;21(Suppl. 1):S271-S276
31
Ikeda, K. et al.:Pharmacometrics. 1992;44(4):433-442
32
Yoshimoto, R. et al.:Pharmacometrics. 1992;44(1):45-51
33
渡辺潔 他:薬理と治療 1995;23(11):3001-3011
34
渡辺潔 他:薬理と治療 1995;23(11):3013-3019
35
高原章 他:日薬理誌 1995;106(4):279-287
36
Hosono, M. et al.:Jpn. J. Pharmacol. 1995;69(2):127-134
37
渡辺潔 他:日薬理誌 1995;106(6):393-399
38
成冨博章 他:薬理と治療 1993;21(Suppl. 1):S259-S269
39
Chibana, T. et al.:Jpn. Heart J. 1992;33(2):239-252
40
常田康夫 他:薬理と治療 1993;21(Suppl. 1):S207-S216