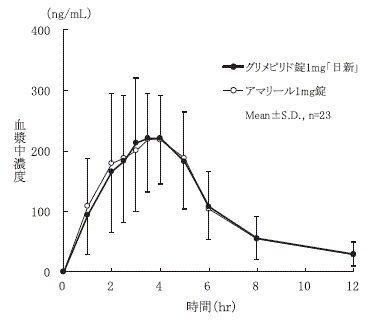
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
糖尿病用薬 インスリン製剤 ビグアナイド系薬剤 チアゾリジン系薬剤 α-グルコシダーゼ阻害剤 DPP-4阻害薬 GLP-1受容体作動薬 SGLT2阻害剤 等 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 血糖降下作用が増強される。 |
プロベネシド | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 腎排泄抑制により血糖降下作用が増強される。 |
クマリン系薬剤 ワルファリンカリウム | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 肝代謝抑制により血糖降下作用が増強される。 |
サリチル酸剤 アスピリン サザピリン 等 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 血中蛋白との結合抑制、サリチル酸剤の血糖降下作用により血糖降下作用が増強される。 |
プロピオン酸系消炎剤 ナプロキセン ロキソプロフェンナトリウム水和物 等 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 血中蛋白との結合抑制により、これらの消炎剤は蛋白結合率が高いので、血中に本剤の遊離型が増加して血糖降下作用が増強するおそれがある。 |
アリール酢酸系消炎剤 アンフェナクナトリウム水和物 ナブメトン 等 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 血中蛋白との結合抑制により、これらの消炎剤は蛋白結合率が高いので、血中に本剤の遊離型が増加して血糖降下作用が増強するおそれがある。 |
オキシカム系消炎剤 ロルノキシカム 等 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 血中蛋白との結合抑制により、これらの消炎剤は蛋白結合率が高いので、血中に本剤の遊離型が増加して血糖降下作用が増強するおそれがある。 |
β-遮断剤 プロプラノロール アテノロール ピンドロール 等 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 糖新生抑制、アドレナリンによる低血糖からの回復抑制、低血糖に対する交感神経症状抑制により血糖降下作用が増強される。 |
モノアミン酸化酵素阻害剤 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | インスリン分泌促進、糖新生抑制により血糖降下作用が増強される。 |
クラリスロマイシン | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 機序不明
左記薬剤が他のスルホニルウレア系薬剤の血中濃度を上昇させたとの報告がある。 |
サルファ剤 スルファメトキサゾール 等 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 血中蛋白との結合抑制、肝代謝抑制、腎排泄抑制により血糖降下作用が増強される。 |
クロラムフェニコール | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 肝代謝抑制により血糖降下作用が増強される。 |
テトラサイクリン系抗生物質 テトラサイクリン塩酸塩 ミノサイクリン塩酸塩 等 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | インスリン感受性促進により血糖降下作用が増強される。 |
シプロフロキサシン レボフロキサシン水和物 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 機序不明 |
フィブラート系薬剤 クロフィブラート ベザフィブラート 等 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 血中蛋白との結合抑制、肝代謝抑制、腎排泄抑制により血糖降下作用が増強される。 |
アゾール系抗真菌剤 ミコナゾール フルコナゾール 等 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | 肝代謝抑制(CYP2C9阻害)、血中蛋白との結合抑制により血糖降下作用が増強される。 |
シベンゾリンコハク酸塩 ジソピラミド ピルメノール塩酸塩水和物 | 低血糖症状が起こることがある。
血糖値その他患者の状態を十分観察し、必要に応じて本剤又は併用薬剤の投与量を調節するなど慎重に投与すること。特にβ-遮断剤と併用する場合にはプロプラノロール等の非選択性薬剤は避けることが望ましい。 | インスリン分泌促進によると考えられる血糖降下作用の増強のおそれがある。 |
アドレナリン | 高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがある。
血糖値その他患者の状態を十分観察しながら投与すること。 | 末梢でのブドウ糖の取り込み抑制、肝臓での糖新生促進により血糖降下作用が減弱される。 |
副腎皮質ホルモン コルチゾン酢酸エステル ヒドロコルチゾン 等 | 高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがある。
血糖値その他患者の状態を十分観察しながら投与すること。 | 肝臓での糖新生促進、末梢組織でのインスリン感受性低下により血糖降下作用が減弱される。 |
甲状腺ホルモン レボチロキシンナトリウム水和物 乾燥甲状腺 等 | 高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがある。
血糖値その他患者の状態を十分観察しながら投与すること。 | 腸管でのブドウ糖吸収亢進、グルカゴンの分泌促進、カテコールアミンの作用増強、肝臓での糖新生促進により血糖降下作用が減弱される。 |
卵胞ホルモン エストラジオール安息香酸エステル エストリオール 等 | 高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがある。
血糖値その他患者の状態を十分観察しながら投与すること。 | 機序不明
コルチゾール分泌変化、組織での糖利用変化、成長ホルモンの過剰産生、肝機能の変化等によると考えられる血糖降下作用の減弱のおそれがある。 |
利尿剤 トリクロルメチアジド フロセミド 等 | 高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがある。
血糖値その他患者の状態を十分観察しながら投与すること。 | インスリン分泌の抑制、末梢でのインスリン感受性の低下により血糖降下作用が減弱される。 |
ピラジナミド | 高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがある。
血糖値その他患者の状態を十分観察しながら投与すること。 | 機序不明
血糖値のコントロールが難しいとの報告がある。 |
イソニアジド | 高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがある。
血糖値その他患者の状態を十分観察しながら投与すること。 | 糖質代謝の障害による血糖値上昇及び耐糖能異常により血糖降下作用が減弱される。 |
リファンピシン | 高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがある。
血糖値その他患者の状態を十分観察しながら投与すること。 | 肝代謝促進(CYP誘導)により血糖降下作用が減弱される。 |
ニコチン酸 | 高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがある。
血糖値その他患者の状態を十分観察しながら投与すること。 | 肝臓でのブドウ糖の同化抑制により血糖降下作用が減弱される。 |
フェノチアジン系薬剤 クロルプロマジン フルフェナジン 等 | 高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがある。
血糖値その他患者の状態を十分観察しながら投与すること。 | インスリン遊離抑制、副腎からのアドレナリン遊離により血糖降下作用が減弱される。 |
フェニトイン | 高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがある。
血糖値その他患者の状態を十分観察しながら投与すること。 | インスリンの分泌阻害により血糖降下作用が減弱される。 |
ブセレリン酢酸塩 | 高血糖症状(嘔気・嘔吐、脱水、呼気のアセトン臭等)が起こることがある。
血糖値その他患者の状態を十分観察しながら投与すること。 | 機序不明
ブセレリン酢酸塩投与により、耐糖能が悪化したという報告がある。 |