1
Fujisaka, Y. et al.:Jpn J Clin Oncol. 2010;40(8):732-738
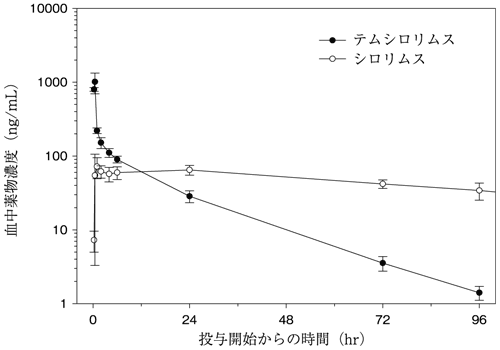
2
社内資料:分布(承認年月日:2010.07.23、CTD 2.7.2.2.2.2)[L20100707003]
3
社内資料:血漿蛋白結合と血球移行(承認年月日:2010.07.23、CTD 2.6.4.4.2.1、2.6.4.4.2.2)[L20100707004]
4
社内資料:代謝及び排泄(承認年月日:2010.07.23、CTD 2.6.4.1.4、2.6.4.5、2.6.4.6.5)[L20100203174]
5
社内資料:肝機能障害患者における薬物動態(承認年月日:2010.07.23、CTD 2.7.2.2.1.8)[L20100707002]
6
社内資料:国際共同(アジア)第Ⅱ相臨床試験(2217-AP試験)(承認年月日:2010.07.23、CTD 2.7.6.19)[L20100707001]
7
社内資料:海外第Ⅲ相臨床試験(304-WW試験)(承認年月日:2010.07.23、CTD 2.7.6.10)[L20100203181]
8
Rini BI:Clin Cancer Res. 2008;14(5):1286-1290
9
社内資料:抗腫瘍作用に関する試験(細胞増殖抑制作用(in vitro))(承認年月日:2010.07.23、CTD 2.6.2.2.1)[L20100203163]
10
社内資料:抗腫瘍作用に関する試験(ヒト腎癌由来細胞移植ヌードマウスに対する作用(in vivo))(承認年月日:2010.07.23、CTD 2.6.2.2.1)[L20100203164]