1
社内資料:生物学的同等性試験(錠0.5mg)
2
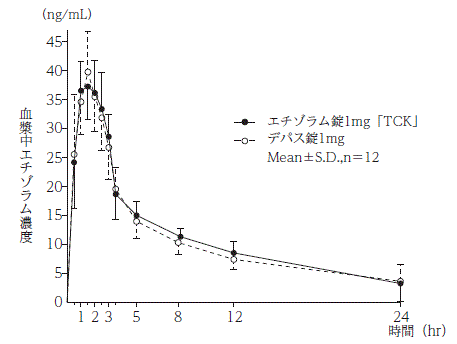
社内資料:生物学的同等性試験(錠1mg)
3
社内資料:生物学的同等性試験(錠0.25mg)
4
第十八改正 日本薬局方解説書. 廣川書店. 2021:C904-C907
精神安定剤
1錠 9.8円
有効成分 | エチゾラム(日局) 0.25mg |
|---|---|
添加剤 | 乳糖水和物、結晶セルロース、クロスカルメロースナトリウム、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール6000、酸化チタン、三二酸化鉄、カルナウバロウ、サラシミツロウ |
有効成分 | エチゾラム(日局) 0.5mg |
|---|---|
添加剤 | 乳糖水和物、結晶セルロース、低置換度ヒドロキシプロピルセルロース、含水二酸化ケイ素、タルク、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール6000、酸化チタン、カルナウバロウ |
有効成分 | エチゾラム(日局) 1mg |
|---|---|
添加剤 | 乳糖水和物、クロスカルメロースナトリウム、結晶セルロース、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール6000、酸化チタン、カルナウバロウ、サラシミツロウ |
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 微赤色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 5.6mm 大きさ(厚さ) 2.5mm 重量 63mg |
| 識別コード |  |
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 白色~微黄色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 6.1mm 大きさ(厚さ) 2.5mm 重量 78mg |
| 識別コード | 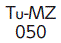 |
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 白色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 6.1mm 大きさ(厚さ) 3.4mm 重量 94mg |
| 識別コード | 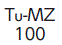 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
中枢神経抑制剤 フェノチアジン誘導体 バルビツール酸誘導体等 | 眠気、血圧低下、運動失調、意識障害などを起こすおそれがある。 | 中枢神経抑制剤との併用で相加的な増強作用が考えられる。 |
MAO阻害剤 | 過鎮静、昏睡、痙攣発作、興奮などを起こすおそれがある。 | MAO阻害剤が本剤の肝での代謝を抑制し、半減期を延長し、血中濃度を上昇させるため作用が増強されることが考えられる。 |
フルボキサミンマレイン酸塩 | 本剤の用量を減量するなど、注意して投与する。 | フルボキサミンマレイン酸塩が本剤の肝での代謝を阻害し、血中濃度を上昇させるため本剤の作用が増強されることがある。 |
アルコール 飲酒 | 精神機能、知覚・運動機能の低下を起こすおそれがある。 | エタノールと本剤は相加的な中枢抑制作用を示すことが考えられる。 |
5%以上 | 0.1~5%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|---|
精神神経系 | 眠気(13.2%)、ふらつき | めまい、歩行失調、頭痛・頭重、言語障害、不眠、酩酊感、焦燥 | 興奮、振戦、眼症状(霧視、調節障害) | 健忘、刺激興奮、錯乱 |
呼吸器 | 呼吸困難感 | |||
循環器 | 動悸、立ちくらみ | |||
消化器 | 口渇、悪心・嘔気、食欲不振、胃・腹部不快感、腹痛、便秘、下痢 | 嘔吐 | ||
過敏症 | 発疹 | 蕁麻疹 | 紅斑、そう痒感 | |
骨格筋 | 倦怠感、脱力感、易疲労感、筋弛緩等の筋緊張低下症状 | |||
その他 | 発汗、排尿障害 | 浮腫、鼻閉 | 乳汁分泌、女性化乳房、高プロラクチン血症、眼瞼痙攣注) |
判定パラメータ | 参考パラメータ | |||
AUC0→24hr (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
エチゾラム錠0.5mg「TCK」 | 48.02±8.05 | 9.64±1.66 | 1.3±0.3 | 6.5±1.4 |
デパス錠0.5mg | 47.37±10.87 | 9.62±1.81 | 1.3±0.3 | 6.5±1.8 |
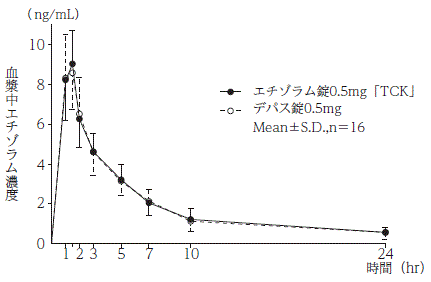
判定パラメータ | 参考パラメータ | |||
AUC0→24hr (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
エチゾラム錠1mg「TCK」 | 277.07±33.78 | 40.39±3.41 | 1.54±0.50 | 13.26±6.10 |
デパス錠1mg | 264.37±44.72 | 41.58±6.48 | 1.46±0.45 | 16.38±16.23 |