1
Iida S, et al.: Int J Hematol. 2010; 92: 118-126.
2
社内資料:レナデックス錠2mg及び4mgの生物学的同等性試験の検討
3
Dimopoulos M, et al.: N Engl J Med. 2007; 357: 2123-2132.
4
Gandhi AK, et al.: Curr Cancer Drug Targets. 2010; 10: 155-167.
5
社内資料:薬理試験の概要文
副腎皮質ホルモン製剤
1錠 167.8円
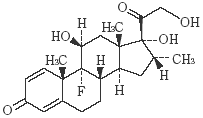
有効成分 | 日本薬局方 デキサメタゾン 2mg(1錠中) |
|---|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、タルク、精製白糖、デンプングリコール酸ナトリウム、ステアリン酸マグネシウム、軽質無水ケイ酸 |
有効成分 | 日本薬局方 デキサメタゾン 4mg(1錠中) |
|---|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、精製白糖、結晶セルロース、クロスポビドン、ステアリン酸マグネシウム |
| 剤形 | 片面割線入りの素錠 |
|---|---|
| 色調 | 白色~灰白色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 7.1mm 大きさ(厚さ) 2.0mm |
| 質量 | 110mg |
| 識別コード | EM32 |
| 剤形 | 片面割線入りの素錠 |
|---|---|
| 色調 | 白色~灰白色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 9.1mm 大きさ(厚さ) 2.5mm |
| 質量 | 200mg |
| 識別コード | EM28 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
デスモプレシン酢酸塩水和物 ミニリンメルト (男性における夜間多尿による夜間頻尿) | 低ナトリウム血症が発現するおそれがある。 | 機序不明 |
リルピビリン エジュラント、リカムビス リルピビリン塩酸塩・テノホビル アラフェナミドフマル酸塩・エムトリシタビン オデフシィ リルピビリン塩酸塩・ドルテグラビルナトリウム ジャルカ | これらの薬剤の血中濃度を低下させ、作用を減弱させるおそれがある。 | 本剤のCYP3A4誘導作用により、これらの薬剤の代謝が促進される可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
主にCYP3A4で代謝される薬剤 イマチニブメシル酸塩 エプレレノン エレトリプタン臭化水素酸塩 ドネペジル塩酸塩等 | これらの薬剤の血中濃度を低下させ、作用を減弱させるおそれがある。 | 本剤のCYP3A4誘導作用により、これらの薬剤の代謝が促進される可能性がある。 |
カスポファンギン酢酸塩 | カスポファンギンの血中濃度が低下するおそれがある。 | 本剤がカスポファンギンの取り込み輸送過程に影響し、カスポファンギンのクリアランス誘導が起きると考えられる。 |
CYP3A4を誘導する薬剤 バルビツール酸誘導体 フェノバルビタール リファンピシン カルバマゼピン等 | 本剤の作用が減弱することが報告されている。 | これらの薬剤はチトクロームP450を誘導し、本剤の代謝が促進される。 |
フェニトイン | 本剤の作用が減弱することが報告されている。 | フェニトインがチトクロームP450を誘導し、本剤の代謝が促進される。 |
フェニトイン | フェニトインの血中濃度が上昇又は低下するとの報告がある。 | 機序不明 |
HIVプロテアーゼ阻害剤 リトナビル ホスアンプレナビルカルシウム水和物 ダルナビルエタノール付加物 | 本剤のAUCが上昇あるいはこれらの薬剤のAUCが低下するおそれがある。 | チトクロームP450に対して競合する可能性がある。また、本剤がチトクロームP450を誘導することより、これらの薬剤の代謝が促進される可能性がある。 |
アプレピタント | 本剤の作用が増強されるおそれがある。 | アプレピタントの用量依存的なCYP3A4阻害作用により、本剤の代謝が阻害される。 |
エンシトレルビル フマル酸 | 本剤の作用が増強されるおそれがある。 | エンシトレルビルのCYP3Aに対する阻害作用により、本剤の代謝が阻害される。 |
マクロライド系抗生物質 エリスロマイシン アゾール系抗真菌剤 イトラコナゾール | 副腎皮質ホルモン剤の作用が増強されるとの報告がある。 | 本剤の代謝が阻害されるおそれがある。 |
メフロキン塩酸塩 | 併用により本剤又はメフロキンの血中濃度が変動するおそれがある。 | メフロキンはCYP3Aにより代謝されることが示唆されており、相互に影響を受ける可能性が考えられる。 |
シクロスポリン | 副腎皮質ホルモン剤の大量投与により、併用したシクロスポリンの血中濃度が上昇するとの報告がある。 | シクロスポリンの代謝を阻害する。 |
サリチル酸誘導体 アスピリン | 併用時に本剤を減量すると、血清中のサリチル酸誘導体の濃度が増加し、サリチル酸中毒を起こすことが報告されている。 | 本剤はサリチル酸誘導体の腎排泄と肝代謝を促進し、血清中のサリチル酸誘導体の濃度が低下する。 |
抗凝血剤 ワルファリンカリウム | 抗凝血剤の作用を減弱させることが報告されている。 | 本剤は血液凝固促進作用がある。 |
経口糖尿病用剤 アセトヘキサミド インスリン製剤 | これらの薬剤の作用を減弱させることが報告されている。 | 本剤は肝臓での糖新生を促進し、末梢組織での糖利用を阻害する。 |
血圧降下剤 | これらの薬剤の作用を減弱させるおそれがある。 | 機序不明 |
利尿剤 | これらの薬剤の作用を減弱させるおそれがある。 | 機序不明 |
利尿剤(カリウム保持性利尿剤を除く) トリクロルメチアジド フロセミド | 低カリウム血症があらわれることがある。 | 本剤は尿細管でのカリウム排泄促進作用がある。 |
カルシウム受容体作動薬 エボカルセト エテルカルセチド塩酸塩 シナカルセト塩酸塩 | 血清カルシウム濃度が低下するおそれがある。 | これらの薬剤の血中カルシウム低下作用が増強される可能性がある。 |
エフェドリン塩酸塩 | 副腎皮質ホルモン剤の代謝が促進され、血中濃度が低下するとの報告がある。 | 機序不明 |
サリドマイド | 血栓症と血栓塞栓症のリスクを高める危険性がある。 | 相互に作用を増強するおそれがある。 |
サリドマイド | 海外において、多発性骨髄腫における本剤との併用により、中毒性表皮壊死症(Toxic Epidermal Necrolysis : TEN)が発現したとの報告がある。 | 機序不明 |
10%以上 | 10%未満 | 頻度不明 | |
|---|---|---|---|
血液 | 好中球減少症、血小板減少症、貧血 | 白血球増多 | |
血管 | 血管浮腫 | ||
内分泌系 | 月経異常 | ||
代謝異常 | 高血糖 | 末梢性浮腫、体重増加、体重減少、浮腫、食欲不振 | 低カリウム性アルカローシス、満月様顔貌、野牛肩、窒素負平衡、脂肪肝、食欲亢進 |
精神・神経系 | 不眠症、錯感覚 | 味覚異常、末梢性ニューロパチー、頭痛、浮動性めまい、うつ病、振戦、気分動揺、錯乱状態、傾眠、不安 | 多幸症、めまい |
眼 | 霧視 | 網膜障害、眼球突出 | |
呼吸器 | 気管支炎 | ||
消化器 | 便秘、腹痛、消化不良、下痢 | 悪心・嘔吐、胃痛、胸やけ、腹部膨満感、口渇 | |
皮膚 | 紅斑 | 発疹、ざ瘡、多毛、脱毛、色素沈着、皮下いっ血、紫斑、線条、そう痒、発汗異常、顔面紅斑、創傷治癒障害、皮膚脆弱化、脂肪織炎 | |
筋・骨格系 | 筋痙攣 | 筋脱力、筋痛 | 関節痛 |
腎 | ステロイド腎症 | ||
その他 | 無力症、疲労 | 発熱、粘膜の炎症 | 血圧上昇、精子数及び精子運動性の異常、しゃっくり |
用量 | 40mg (6例) |
Cmax(ng/mL) | 521±168 |
AUC∞(ng・h/mL) | 3977±2010 |
tmax(h) | 2.49 (1.00, 4.00) |
t1/2(h) | 4.45±1.71 |
レナデックス錠2mg 2錠 (20例) | レナデックス錠4mg 1錠 (20例) | 最小二乗幾何平均値の比 (2mg錠/4mg錠) | 比の90%信頼区間 | |
Cmax (ng/mL) | 47.3 (22.0) | 47.0 (25.2) | 1.0064 | 0.8868, 1.1420 |
AUCt (ng・h/mL) | 183 (21.7) | 182 (21.5) | 1.0033 | 0.9602, 1.0484 |
tmax (h) | 1.00 (0.50, 2.00) | 0.75 (0.50, 3.00) | - | - |
t1/2 (h) | 3.90 (13.9) | 3.96 (11.5) | - | - |
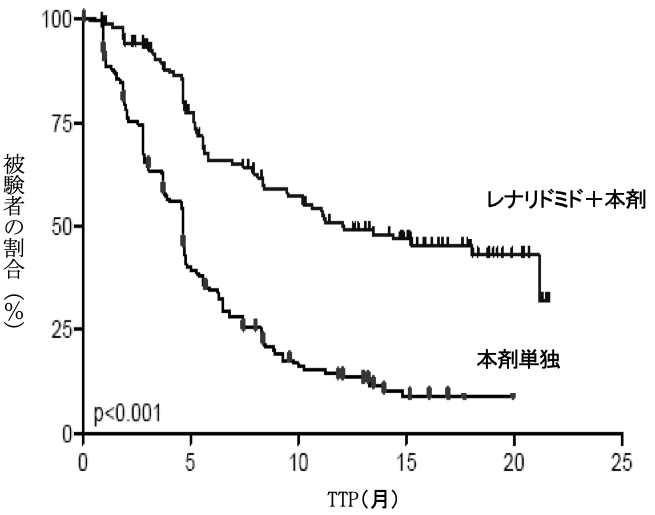
レナリドミド+本剤群 (176例) | 本剤単独群 (175例) | |
無増悪期間(TTP) | ||
イベント発生者数 (%) | 68(38.6) | 130(74.3) |
中央値a(週) [95%信頼区間]b | 52.1 [40.9, NE] | 20.1 [16.6, 20.7] |
ハザード比c [95%信頼区間] | 0.324 [0.240, 0.438] | |
p値 (Log-rank検定) | <0.001 | |
全生存期間(OS) | ||
死亡患者数(%) | 48(27.3) | 60(34.3) |
中央値a(週) [95%信頼区間]b | NE [NE] | NE [71.6, NE] |
ハザード比c [95%信頼区間] | 0.730 [0.498, 1.070] | |
p値 (Log-rank検定) | 0.105 | |