作成又は改訂年月
**
2020年9月改訂
(第7版)
*
2019年3月改訂
日本標準商品分類番号
薬効分類名
承認等
販売名
セフォチアム塩酸塩静注用0.25g「日医工」
販売名コード
承認・許可番号
22300AMX01200000
Cefotiam Hydrochloride
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
室温保存
使用期限:
外箱及びバイアルに表示の使用期限内に使用すること。
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
1バイアル中
セフォチアム塩酸塩
0.25g(力価)
添加物
1バイアル中
pH調節剤 適量
(無水炭酸ナトリウム)
製剤の性状
| 剤形・性状 | 粉末注射剤
白色〜淡黄色 |
|---|
| pH | 5.7〜7.2〔0.5g(力価)/5mL(水)〕 |
|---|
3| 浸透圧比 | 約1〔25mg(力価)/mL(注射用水)〕
(生理食塩液に対する比) |
|---|
販売名
セフォチアム塩酸塩静注用0.5g「日医工」
販売名コード
承認・許可番号
22300AMX01201000
Cefotiam Hydrochloride
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
室温保存
使用期限:
外箱及びバイアルに表示の使用期限内に使用すること。
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
1バイアル中
セフォチアム塩酸塩
0.5g(力価)
添加物
1バイアル中
pH調節剤 適量
(無水炭酸ナトリウム)
製剤の性状
| 剤形・性状 | 粉末注射剤
白色〜淡黄色 |
|---|
| pH | 5.7〜7.2〔0.5g(力価)/5mL(水)〕 |
|---|
3| 浸透圧比 | 約1〔25mg(力価)/mL(注射用水)〕
(生理食塩液に対する比) |
|---|
販売名
セフォチアム塩酸塩静注用1g「日医工」
販売名コード
承認・許可番号
22400AMX00837000
Cefotiam Hydrochloride
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
室温保存
使用期限:
外箱及びバイアルに表示の使用期限内に使用すること。
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
1バイアル中
セフォチアム塩酸塩
1g(力価)
添加物
1バイアル中
乾燥炭酸ナトリウム
250mg
製剤の性状
| 剤形・性状 | 粉末注射剤
白色〜淡黄色 |
|---|
| pH | 5.7〜7.2〔0.5g(力価)/5mL(水)〕 |
|---|
3| 浸透圧比 | 約1〔25mg(力価)/mL(注射用水)〕
(生理食塩液に対する比) |
|---|
禁忌
原則禁忌
*セフェム系抗生物質に対し過敏症の既往歴のある患者
効能又は効果
効能又は効果に関連する使用上の注意
**扁桃炎(扁桃周囲炎,扁桃周囲膿瘍を含む),急性気管支炎,中耳炎,副鼻腔炎への使用にあたっては,「抗微生物薬適正使用の手引き」1)を参照し,抗菌薬投与の必要性を判断した上で,本剤の投与が適切と判断される場合に投与すること。
<適応菌種>
セフォチアムに感性のブドウ球菌属,レンサ球菌属,肺炎球菌,大腸菌,シトロバクター属,クレブシエラ属,エンテロバクター属,プロテウス属,モルガネラ・モルガニー,プロビデンシア・レットゲリ,インフルエンザ菌
<適応症>
敗血症,深在性皮膚感染症,慢性膿皮症,外傷・熱傷及び手術創等の二次感染,骨髄炎,関節炎,扁桃炎(扁桃周囲炎,扁桃周囲膿瘍を含む),急性気管支炎,肺炎,肺膿瘍,膿胸,慢性呼吸器病変の二次感染,膀胱炎,腎盂腎炎,前立腺炎(急性症,慢性症),腹膜炎,胆嚢炎,胆管炎,バルトリン腺炎,子宮内感染,子宮付属器炎,子宮旁結合織炎,化膿性髄膜炎,中耳炎,副鼻腔炎
用法及び用量
通常,成人にはセフォチアム塩酸塩として1日0.5〜2g(力価)を2〜4回に分け,また,小児にはセフォチアム塩酸塩として1日40〜80mg(力価)/kgを3〜4回に分けて静脈内に注射する。
なお,年齢,症状に応じ適宜増減するが,成人の敗血症には1日4g(力価)まで,小児の敗血症,化膿性髄膜炎等の重症・難治性感染症には1日160mg(力価)/kgまで増量することができる。
静脈内注射に際しては,日局「注射用水」,日局「生理食塩液」又は日局「ブドウ糖注射液」に溶解して用いる。
また,成人の場合は本剤の1回用量0.25〜2g(力価)を糖液,電解質液又はアミノ酸製剤などの補液に加えて,30分〜2時間で点滴静脈内注射を行うこともできる。
なお,小児の場合は上記投与量を考慮し,補液に加えて,30分〜1時間で点滴静脈内注射を行うこともできる。
用法及び用量に関する説明
<注射液の調製法と調製時の注意>
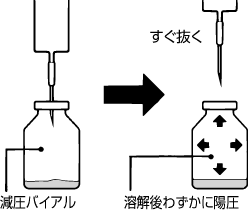
本品は炭酸ナトリウムを含有し,溶解時に炭酸ガスを発生するため減圧バイアルにしてある。溶解にあたっては約5mLの溶解液をバイアル内へ注入し,すぐ注射針を抜き取り振とうして溶解する。
〔注意〕
バイアル内へは約5mL以上の溶解液を注入しないこと。
通常の操作で約5mLの溶解液が容易に入らない場合は使用しないこと。
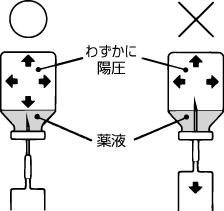
溶解後,バイアルを倒立にして,注射針を刺入し,薬液を吸引する。
〔注意〕
わずかに陽圧になっているので注射針の先が薬液面より上に出ないように刺入すること。
なお,静脈内注射に際しては0.25gは通常10mLに,0.5g及び1gは通常20mLに希釈して投与する。点滴静脈内注射を行う場合,注射用水を用いると溶液が等張とならないため用いないこと。
本剤の注射液調製時にショックを伴う接触蕁麻疹があらわれることがあるので調製時に手の腫脹・そう痒・発赤,全身の発疹・そう痒,腹痛,悪心,嘔吐等の症状があらわれた場合には以後本剤との接触を避けること。
用法及び用量に関連する使用上の注意
高度の腎障害のある患者には,投与量・投与間隔の適切な調節をするなど慎重に投与すること。
本剤の使用にあたっては,耐性菌の発現等を防ぐため,原則として感受性を確認し,疾病の治療上必要な最小限の期間の投与にとどめること。
使用上の注意
慎重投与
ペニシリン系抗生物質に対し過敏症の既往歴のある患者
本人又は両親,兄弟に気管支喘息,発疹,蕁麻疹等のアレルギー症状を起こしやすい体質を有する患者
高度の腎障害のある患者[高い血中濃度が持続することがある。]
高齢者(「高齢者への投与」の項参照)
経口摂取の不良な患者又は非経口栄養の患者,全身状態の悪い患者[ビタミンK欠乏症状があらわれることがあるので観察を十分に行うこと。]
重要な基本的注意
本剤によるショック,アナフィラキシーの発生を確実に予知できる方法がないので,次の措置をとること。
事前に既往歴等について十分な問診を行うこと。なお,抗生物質等によるアレルギー歴は必ず確認すること。
投与に際しては,必ずショック等に対する救急処置のとれる準備をしておくこと。
投与開始から投与終了後まで,患者を安静の状態に保たせ,十分な観察を行うこと。特に,投与開始直後は注意深く観察すること。
相互作用
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
利尿剤
フロセミド等 | 他のセフェム系抗生物質で併用による腎障害増強作用が報告されているので,併用する場合には腎機能に注意すること。 | 機序は不明であるが,利尿時の脱水による血中濃度の上昇等が考えられている。 |
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
ショック,アナフィラキシー(頻度不明)
ショック,アナフィラキシーを起こすことがあるので,観察を十分に行い,不快感,口内異常感,眩暈,便意,耳鳴,発汗,喘鳴,呼吸困難,血管浮腫,全身の潮紅・蕁麻疹等の異常が認められた場合には投与を中止し,適切な処置を行うこと。
急性腎障害等の重篤な腎障害(頻度不明)
急性腎障害等の重篤な腎障害があらわれることがあるので,定期的に検査を行うなど観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
汎血球減少,無顆粒球症,顆粒球減少,溶血性貧血,血小板減少(頻度不明)
汎血球減少,無顆粒球症,顆粒球減少,溶血性貧血,血小板減少があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止するなど適切な処置を行うこと。
偽膜性大腸炎等の血便を伴う重篤な大腸炎(頻度不明)
偽膜性大腸炎等の血便を伴う重篤な大腸炎があらわれることがある。腹痛,頻回の下痢があらわれた場合には直ちに投与を中止するなど適切な処置を行うこと。
間質性肺炎,PIE症候群(頻度不明)
発熱,咳嗽,呼吸困難,胸部X線異常,好酸球増多等を伴う間質性肺炎,PIE症候群等があらわれることがあるので,このような症状があらわれた場合には投与を中止し,副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN),皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN),皮膚粘膜眼症候群(Stevens-Johnson症候群)があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
痙攣(頻度不明)
痙攣等の中枢神経症状があらわれることがある。特に,腎不全患者にあらわれやすい。(「用法・用量に関連する使用上の注意」の項参照)
肝炎,肝機能障害,黄疸(頻度不明)
AST(GOT),ALT(GPT)の著しい上昇等を伴う肝炎,肝機能障害,黄疸があらわれることがあるので,観察を十分に行い,異常が認められた場合には投与を中止し,適切な処置を行うこと。
その他の副作用
| | 頻度不明 |
| 過敏症注1) | 発疹,蕁麻疹,紅斑,そう痒,発熱,リンパ腺腫脹,関節痛 |
| 血液 | 貧血,好酸球増多 |
| 肝臓 | AST(GOT)上昇,ALT(GPT)上昇,Al-P上昇,LDH上昇,γ-GTP上昇 |
| 消化器 | 悪心,下痢,嘔吐,食欲不振,腹痛 |
| 菌交代症 | 口内炎,カンジダ症 |
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症,出血傾向等),ビタミンB群欠乏症状(舌炎,口内炎,食欲不振,神経炎等) |
| その他 | めまい,頭痛,倦怠感,しびれ感 |
その他の副作用の注意
注1)このような場合には投与を中止し適切な処置を行うこと。
高齢者への投与
次の点に注意し,用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。
高齢者では生理機能が低下していることが多く副作用が発現しやすい。
高齢者ではビタミンK欠乏による出血傾向があらわれることがある。
妊婦,産婦,授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[妊娠中の投与に関する安全性は確立していない。]
小児等への投与
低出生体重児,新生児に対する安全性は確立していない。
臨床検査結果に及ぼす影響
テステープ反応を除くベネディクト試薬,フェーリング試薬による尿糖検査では,偽陽性を呈することがあるので注意すること。
直接クームス試験陽性を呈することがあるので注意すること。
適用上の注意
投与経路
本剤は静脈内注射にのみ使用すること。
投与方法
静脈内大量投与により,まれに血管痛,血栓性静脈炎を起こすことがあるので,これを予防するために注射液の調製,注射部位,注射方法等について十分注意し,その注射速度はできるだけ遅くすること。
溶解後
溶解後は速やかに使用すること。なお,やむを得ず保存を必要とする場合でも8時間以内に使用すること。この場合,微黄色の溶液の色調が時間の経過とともに濃くなることがある。
小児に点滴静脈内注射を行う際には,十分な血中濃度を得るために,30分〜1時間で投与を行うこと。
その他の注意
本剤の投与に際しては,定期的に肝機能,腎機能,血液等の検査を行うことが望ましい。
薬効薬理
セフォチアムは,グラム陽性菌及び陰性菌に対して広範な抗菌活性を示し,その抗菌力はグラム陽性菌ではセファゾリンとほぼ同等,グラム陰性菌に対してはセファゾリン及びセフメタゾールより明らかに強い。また,臨床分離のインフルエンザ菌においては,セファゾリンと比較して本剤に高い感受性が認められている。
セフォチアムは,細菌細胞壁の合成を阻害する。細胞外膜透過性に優れ,β-ラクタマーゼに比較的安定で,かつ細胞壁ペプチドグリカン架橋形成阻害作用が強いため,グラム陰性菌に対し強い抗菌力を示すものと考えられている。2)
有効成分に関する理化学的知見
一般名:
セフォチアム塩酸塩(Cefotiam Hydrochloride)
略号:
CTM
化学名:
(6R,7R)-7-[2-(2-Aminothiazol-4-yl)acetylamino]-3-[1-(2-dimethylaminoethyl)-1H-tetrazol-5-ylsulfanylmethyl]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid dihydrochloride
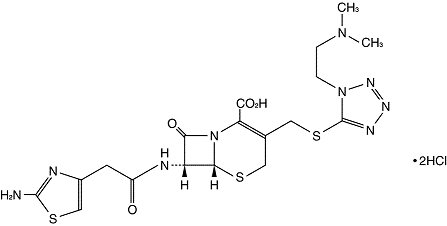
構造式:
分子式:
C18H23N9O4S3・2HCl
分子量:
598.55
白色〜淡黄色の結晶又は結晶性の粉末である。
水,メタノール又はホルムアミドに溶けやすく,エタノール(95)に溶けにくく,アセトニトリルにほとんど溶けない。
取扱い上の注意
安定性試験
本品につき加速試験(40℃,6ヵ月)を行った結果,セフォチアム塩酸塩静注用0.25g「日医工」,セフォチアム塩酸塩静注用0.5g「日医工」及びセフォチアム塩酸塩静注用1g「日医工」は通常の市場流通下において3年間安定であることが推測された。3)
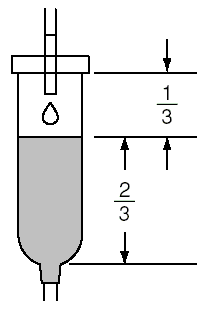
点滴静脈内注射時
点滴開始時
薬剤溶解後に炭酸ガスが発生し,点滴筒内の液面が下がるので,あらかじめ点滴筒の2/3まで薬液を溜めた後,点滴を開始すること。(点滴開始時に液面が低い場合,チューブ内にエアーが入ることがある。)
包装
セフォチアム塩酸塩静注用0.25g「日医工」
0.25g(力価)×10バイアル
セフォチアム塩酸塩静注用0.5g「日医工」
0.5g(力価)×10バイアル
セフォチアム塩酸塩静注用1g「日医工」
1g(力価)×10バイアル
主要文献及び文献請求先
主要文献
1
厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
2
第十七改正日本薬局方解説書 C-2668,廣川書店,東京(2016)
3
日医工ファーマ株式会社 社内資料:安定性試験
文献請求先
主要文献欄に記載の文献・社内資料は下記にご請求下さい。
日医工株式会社 お客様サポートセンター
〒930-8583 富山市総曲輪1丁目6番21
フリーダイアル(0120)517-215
Fax(076)442-8948
製造販売業者等の氏名又は名称及び住所
販売元
日医工株式会社
富山市総曲輪1丁目6番21
製造販売元
日医工ファーマ株式会社
富山市総曲輪1丁目6番21