1
Dubourg J. et al.:Diabetes Obes Metab. 2022;24:609-619
2
Tuchmann-Duplessis H. et al.:Compt.Rend. 1961;253:321-323
3
前芝良宏 他:薬理と治療. 1996;24:2597-2617
4
Lewis J.D. et al.:JAMA. 2015;314:265-277
5
Korhonen P. et al.:BMJ. 2016;354:i3903
6
Azoulay L. et al.:BMJ. 2012;344:e3645
7
Hsiao F.Y. et al.:Drug Safety. 2013;36:643-649
8
Saez E. et al.:Nature Medicine. 1998;4:1058-1061
9
Lefebvre A.M. et al.:Nature Medicine. 1998;4:1053-1057
10
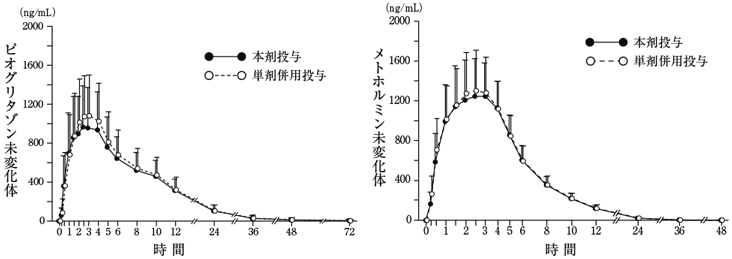
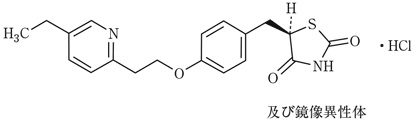
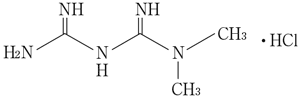
社内資料:生物学的同等性試験
11
Karim A. et al.:J.Clin.Pharmacol. 2007;47:48-55
12
平賀興吾:臨牀と研究. 1997;74:1184-1201
13
社内資料:ヒトP450分子種発現系ミクロゾームによる代謝に関する試験
14
社内資料:チトクロームP450(CYP)に対する影響に関する試験
15
Scheen A.J.:Drug Safety. 2005;28:601-631
16
社内資料:Study No.AE-4997-G,Final Report
17
東 純一 他:臨牀と研究. 1997;74:1627-1637
18
Sambol N.C. et al.:J.Clin.Pharmacol.1995;35:1094-1102
19
Sugiyama Y. et al.:Arzneimittelforschung. 1990;40:263-267
20
Sugiyama Y. et al.:Arzneimittelforschung. 1990;40:436-440
21
Hayakawa T. et al.:Biochem.Biophys.Res.Commun. 1996;223:439-444
22
Murase K. et al.:Diabetologia. 1998;41:257-264
23
Lee A.J.:Pharmacotherapy. 1996;16:327-351
24
池田 衡 他:薬理と治療. 1997;25:337-343
25
Proske G. et al.:Arzneimittelforschung. 1962;12:314-318
26
Opitz K. et al.:Deut.Med.Wochenschr. 1962;87:105-106
27
Sterne J.:Therapie. 1958;13:650-659
28
小澤 光 他:日薬理誌. 1971;67:12-13
29
Kroneberg G. et al.:Arzneimittelforschung. 1958;8:470-475






 321
321


 322
322