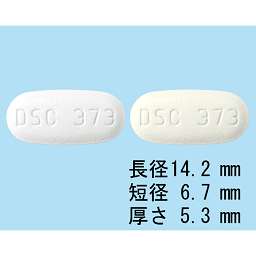
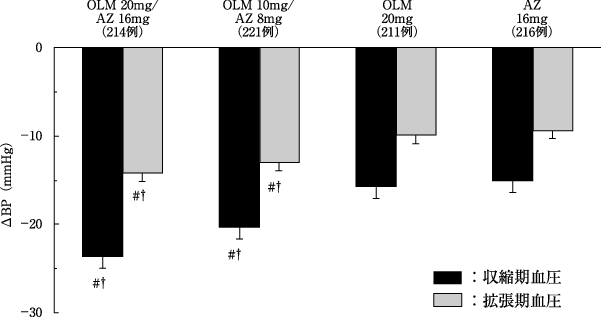
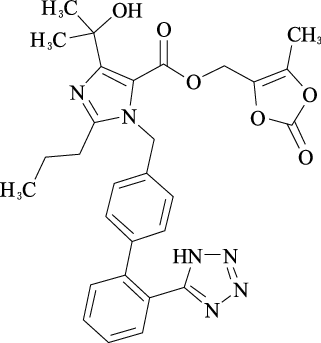
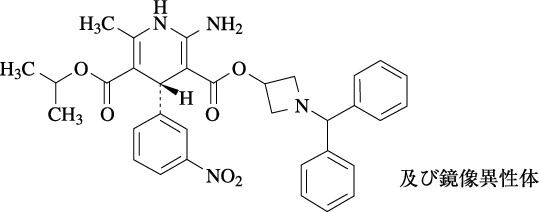
1
阿部真也ほか:周産期医学 2017;47:1353-1355
2
齊藤大祐ほか:鹿児島産科婦人科学会雑誌 2021;29:49-54
3
von Bergmann K, et al.:J Hypertens. 2001;19(S1):S33-S40
4
小口寿夫ほか:臨床医薬 1999;15(5):765-777
5
社内資料:肝機能障害患者における薬物動態(カルブロック錠 2003年1月31日承認、申請資料概要 ヘ-Ⅲ-1)
6
桑島 巌ほか:臨床医薬 2000;16(3):375-387
7
社内資料:各種高血圧モデルにおける降圧作用の検討(2010年1月20日承認、CTD2.6.2.2)