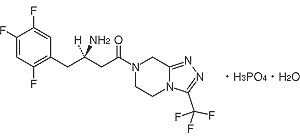
1
Herman G.A. et al.:Br.J.Clin.Pharmacol.,2011;71:429-436
2
片山泰之ほか:新薬と臨床,2011;60:1139-1152
3
Bergman A. et al.:Biopharma Drug Dispos.,2007;28:315-322
4
Vincent S.H. et al.:Drug Metab.Dispos.,2007;35:533-538
5
Chu X.Y. et al.:J.Pharmacol.Exp.Ther.,2007;321:673-683
6
Bergman A.J. et al.:Diabetes Care,2007;30:1862-1864
7
Migoya E.M. et al.:Can.J.Clin.Pharmacol.,2009;16:e165-170
8
Krishna R. et al.:J.Clin.Pharmacol.,2007;47:165-174
9
Herman G.A. et al.:Curr.Med.Res.Opin.,2006;22:1939-1947
10
Mistry G.C. et al.:J.Clin.Pharmacol.,2007;47:159-164
11
Mistry G.C. et al.:Br.J.Clin.Pharmacol.,2008;66:36-42
12
Bergman A.J. et al.:J.Clin.Pharmacol.,2009;49:483-488
13
Wright D.H. et al.:J.Clin.Pharmacol.,2009;49:1157-1167
14
Migoya E. et al.:J.Clin.Pharmacol.,2011;51:1319-1325
15
Iwamoto Y. et al.:Endocr. J.,2010;57:383-394
16
Iwamoto Y. et al.:Diabetes Obes.Metab.,2010;12:613-622
17
Odawara M. et al.:Diabetol.Int.,2011;2:94-105
18
Tajima N. et al.:Diabetol.Int.,2011;2:32-44
19
Kashiwagi A. et al.:J.Diabetes Investig.,2011;2:381-390
20
Kadowaki T. et al.:J.Diabetes Investig.,2013;4:174-181
21
Tajima N. et al.:J.Diabetes Investig.,2013;4:595-604
22
Tajima N. et al.:Diabetol.Int.,2016;7:155-166
23
Kadowaki T. et al.:Diabetol.Int.,2013;4:160-172
24
Drucker D.J.:Diabetes Care,2003;26:2929-2940
25
Kim D. et al.:J.Med.Chem.,2005;48:141-151
26
Herman G.A. et al.:J.Clin.Endocrinol.Metab.,2006;91:4612-4619
27
小野薬品工業:シタグリプチンのin vitro及びin vivo薬理試験(2009年10月16日承認、CTD 2.6.2.2)
28
Nonaka K. et al.:Diabetes Res.Clin.Pract.,2008;79:291-298