作成又は改訂年月
**
2020年9月改訂
(第6版)
*
2020年3月改訂
日本標準商品分類番号
薬効分類名
承認等
販売名
セフェピム塩酸塩静注用0.5g「サンド」
販売名コード
承認・許可番号
22100AMX01951000
Cefepime Dihydrochloride for Intravenous Injection 0.5g [SANDOZ]
薬価基準収載年月
販売開始年月
貯法・使用期限等
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
日局 セフェピム塩酸塩水和物
含量(1バイアル中)
0.5g(力価)
添加物
L-アルギニン 0.354g
性状
| 色・剤形(又は性状) | 白色〜微黄色の粉末 |
|---|
| pH | 4.0〜6.0(0.5g(力価)/5mL日局注射用水) |
|---|
| 浸透圧比(日局生理食塩液に対する比) | 約1(1g(力価)/20mL日局注射用水)
約2(1g(力価)/20mL日局生理食塩液)
約1(1g(力価)/100mL日局生理食塩液)
約2(1g(力価)/20mL5%日局ブドウ糖注射液)
約1(1g(力価)/100mL5%日局ブドウ糖注射液) |
|---|
販売名
セフェピム塩酸塩静注用1g「サンド」
販売名コード
承認・許可番号
22100AMX01952000
Cefepime Dihydrochloride for Intravenous Injection 1g [SANDOZ]
薬価基準収載年月
販売開始年月
貯法・使用期限等
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
有効成分
日局 セフェピム塩酸塩水和物
含量(1バイアル中)
1g(力価)
添加物
L-アルギニン 0.708g
性状
| 色・剤形(又は性状) | 白色〜微黄色の粉末 |
|---|
| pH | 4.0〜6.0(0.5g(力価)/5mL日局注射用水) |
|---|
| 浸透圧比(日局生理食塩液に対する比) | 約1(1g(力価)/20mL日局注射用水)
約2(1g(力価)/20mL日局生理食塩液)
約1(1g(力価)/100mL日局生理食塩液)
約2(1g(力価)/20mL5%日局ブドウ糖注射液)
約1(1g(力価)/100mL5%日局ブドウ糖注射液) |
|---|
一般的名称
注射用セフェピム塩酸塩
Cefepime Dihydrochloride Hydrate
禁忌
原則禁忌
効能又は効果
効能又は効果に関連する使用上の注意
**扁桃炎(扁桃周囲膿瘍を含む)、中耳炎、副鼻腔炎
扁桃炎(扁桃周囲膿瘍を含む)、中耳炎、副鼻腔炎への使用にあたっては、「抗微生物薬適正使用の手引き」1)を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
発熱性好中球減少症
本剤は、以下の2条件を満たす症例に投与すること。
1回の検温で38℃以上の発熱、又は1時間以上持続する37.5℃以上の発熱
好中球数が500/mm3未満の場合、又は1000/mm3未満で500/mm3未満に減少することが予測される場合
発熱性好中球減少症の患者への本剤の使用は、国内外のガイドラインを参照し、本疾患の治療に十分な経験を持つ医師のもとで、本剤の使用が適切と判断される症例についてのみ実施すること。
発熱性好中球減少症に対し、本剤を投与する場合には、本剤投与前に血液培養を実施すること。起炎菌が判明した際には、本剤投与継続の必要性を検討すること。
発熱性好中球減少症の患者への使用にあたっては、本剤投与の開始時期の指標である好中球数が緊急時等で確認できない場合には、白血球数の半数を好中球数として推定すること。
一般感染症
〈適応菌種〉
セフェピムに感性のブドウ球菌属、レンサ球菌属、肺炎球菌、モラクセラ(ブランハメラ)・カタラーリス、大腸菌、シトロバクター属、クレブシエラ属、エンテロバクター属、セラチア属、プロテウス属、モルガネラ・モルガニー、プロビデンシア属、インフルエンザ菌、シュードモナス属、緑膿菌、バークホルデリア・セパシア、ステノトロホモナス(ザントモナス)・マルトフィリア、アシネトバクター属、ペプトストレプトコッカス属、バクテロイデス属、プレボテラ属(プレボテラ・ビビアを除く)
〈適応症〉
敗血症、深在性皮膚感染症、外傷・熱傷及び手術創等の二次感染、肛門周囲膿瘍、扁桃炎(扁桃周囲膿瘍を含む)、肺炎、肺膿瘍、慢性呼吸器病変の二次感染、複雑性膀胱炎、腎盂腎炎、前立腺炎(急性症、慢性症)、腹膜炎、腹腔内膿瘍、胆嚢炎、胆管炎、子宮内感染、子宮旁結合織炎、中耳炎、副鼻腔炎
発熱性好中球減少症
用法及び用量
本剤の使用に際しては、投与開始後3日をめやすとしてさらに継続投与が必要か判定し、投与中止又はより適切な他剤に切り替えるべきか検討を行うこと。さらに、本剤の投与期間は、原則として14日以内とすること。
一般感染症
通常成人には、症状により1日1〜2g(力価)を2回に分割し、静脈内注射又は点滴静注する。
なお、難治性又は重症感染症には、症状に応じて1日量を4g(力価)まで増量し分割投与する。
発熱性好中球減少症
通常成人には、1日4g(力価)を2回に分割し、静脈内注射又は点滴静注する。
静脈内注射の場合は、日局注射用水、日局生理食塩液又は日局ブドウ糖注射液に溶解し、緩徐に注射する。
また、点滴静注の場合は、糖液、電解質液又はアミノ酸製剤などの補液に加えて30分〜1時間かけて点滴静注する。
用法及び用量に関連する使用上の注意
本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
腎障害患者
腎障害のある患者には、投与量を減ずるか、投与間隔をあけるなど慎重に投与すること。(「慎重投与」の項参照)
使用上の注意
慎重投与
ペニシリン系抗生物質に対し過敏症の既往歴のある患者
本人又は両親、兄弟に気管支喘息、発疹、蕁麻疹等のアレルギー症状を起こしやすい体質を有する患者
高度の腎障害のある患者[血中濃度が持続するので、投与量を減ずるか、投与間隔をあけて投与すること。]
高度の肝障害のある患者[肝障害を増強させるおそれがある。]
高齢者(「高齢者への投与」の項参照)
経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者[ビタミンK欠乏症状があらわれることがあるので観察を十分に行うこと。]
重要な基本的注意
*本剤によるショック、アナフィラキシーの発生を確実に予知できる方法がないので、次の措置をとること。
事前に既往歴等について十分な問診を行うこと。なお、抗生物質等によるアレルギー歴は必ず確認すること。
投与に際しては、必ずショック等に対する救急処置のとれる準備をしておくこと。
投与開始から投与終了後まで、患者を安静の状態に保たせ、十分な観察を行うこと。特に、投与開始直後は注意深く観察すること。
本剤投与前に感受性の確認が行えなかった場合、本剤投与開始後3日を目安として本剤に対する感受性を確認し、本剤投与が適正であるか判断すること。なお、本剤に感受性が認められない場合、速やかに他の薬剤に変更すること。
患者の状態などから判断して、7日以上にわたって本剤を投与する場合には、その理由を常時明確にし、発疹の出現や肝機能異常等の副作用に留意し、漫然とした継続投与は行わないこと。
発熱性好中球減少症の治療において、本剤は、好中球減少症でありかつ発熱が認められた場合に限定して使用すること(〈効能又は効果に関連する使用上の注意〉の項参照)。
発熱性好中球減少症の治療においては、好中球数、発熱の回復が認められた場合には、本剤の投与中止を考慮すること。
発熱性好中球減少症の患者への使用にあたっては、腫瘍熱・薬剤熱等の非感染性の発熱であることが確認された場合には速やかに投与を中止すること。
相互作用
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
利尿剤
フロセミド 等 | 類似化合物(他のセフェム系抗生物質)で腎障害増強作用が報告されているので、併用する場合には腎機能に注意すること。 | 機序は不明であるが、利尿時の脱水による血中濃度の上昇が考えられる。 |
|---|
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
*ショック、アナフィラキシー(頻度不明)
ショック、アナフィラキシーがあらわれることがあるので観察を十分に行い、呼吸困難、全身潮紅、血管浮腫、蕁麻疹、血圧低下等があらわれた場合には投与を中止し、適切な処置を行うこと。
偽膜性大腸炎(頻度不明)
偽膜性大腸炎等の血便を伴う重篤な大腸炎があらわれることがある。腹痛、頻回の下痢があらわれた場合には直ちに投与を中止するなど適切な処置を行うこと。
*急性腎障害(頻度不明)
急性腎障害等の重篤な腎障害があらわれることがあるので、定期的に検査を行うなど観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
汎血球減少、無顆粒球症、血小板減少(頻度不明)
汎血球減少、無顆粒球症、血小板減少があらわれることがあるので、定期的に検査を行うなど観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
間質性肺炎、PIE症候群(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線像異常、好酸球増多等を伴う間質性肺炎、PIE症候群等があらわれることがあるので、観察を十分に行い、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
中毒性表皮壊死融解症、皮膚粘膜眼症候群があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
肝機能障害、黄疸(頻度不明)
AST(GOT)、ALT(GPT)、Al-P、LDH、γ-GTP、LAPの上昇等を伴う肝機能障害や黄疸があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
精神神経症状(頻度不明)
意識障害、昏睡、痙攣、振戦、ミオクローヌス等の精神神経症状があらわれることがある。特に腎機能障害患者で減量を行わなかった場合にあらわれやすい。
重大な副作用(類薬)
溶血性貧血
他のセフェム系抗生物質で溶血性貧血があらわれることが報告されているので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
その他の副作用
過敏症注1)
頻度不明
発疹、蕁麻疹、紅斑、そう痒、発熱
血液
頻度不明
貧血、顆粒球減少、好酸球増多、血小板増多
腎臓
頻度不明
BUN上昇、クレアチニン上昇、蛋白尿、血清カリウム上昇
肝臓
頻度不明
AST(GOT)上昇注2)、ALT(GPT)上昇注2)、Al-P上昇、LDH上昇、γ-GTP上昇、ビリルビン上昇、LAP上昇
消化器
頻度不明
下痢、悪心、嘔吐、食欲不振、腹痛、便秘
精神神経系
頻度不明
めまい、しびれ
菌交代症
頻度不明
カンジダ症、口内炎
ビタミン欠乏症
頻度不明
ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等)
その他
頻度不明
頭痛、点滴中の気分不良、血圧低下、顔面紅潮、悪寒、味覚異常
上記のような症状又は異常があらわれた場合には、投与を中止するなど適切な処置を行うこと。
注1)このような場合には投与を中止すること。
注2)投与期間が長くなるに従い、AST(GOT)、ALT(GPT)の上昇等の臨床検査値異常変動の発現率が高くなる傾向が認められているので、やむを得ず10日を越えて連日投与する場合には、定期的に検査を行うなど注意すること。
高齢者への投与
高齢者では腎機能が低下していることが多いため高い血中濃度が持続するおそれがあるので、1回0.5gから投与を開始し、次の点に注意し、患者の状態を観察しながら慎重に投与すること。
発疹、発熱等のアレルギー症状並びに下痢等の消化器症状等の副作用が報告されている。
他のセフェム系抗生物質においてビタミンK欠乏による出血傾向があらわれたとの報告がある。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[妊娠中の投与に関する安全性は確立していない。]
本剤投与中は授乳を避けさせること。[ヒト母乳中へ移行することがある。]
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない(使用経験がない)。
臨床検査結果に及ぼす影響
テステープ反応を除くベネディクト試薬、フェーリング試薬、クリニテストによる尿糖検査では偽陽性を呈することがあるので注意すること。
直接クームス試験陽性を呈することがあるので注意すること。
過量投与
過量投与により、意識障害、痙攣等の精神神経症状を起こすことがある。特に腎機能障害患者ではこのような症状があらわれやすい。なお、本剤は血液透析により体内から除去されるが、腹膜透析は有効ではない。
適用上の注意
投与経路
本剤は静脈内注射にのみ使用すること。
投与速度
静脈内大量投与により、血管痛、血栓性静脈炎を起こすことがあるので、これを予防するために注射液の調製、注射部位、注射方法等について十分注意し、その注射速度はできるだけ遅くすること。また、点滴静注は30分以上かけて静脈内に注射すること。
調製方法
調製後は速やかに使用すること。
配合変化
ガベキサートメシル酸塩製剤と配合すると、配合直後に沈殿が起こることがあるので、配合を避けること。
薬効薬理
セフェピム塩酸塩水和物は、細菌の細胞壁合成阻害により強い殺菌作用を示す。大腸菌ではペニシリン結合蛋白のうち、特にPBP 1 Bs、2及び3に親和性が高く、また黄色ブドウ球菌ではPBP 1及び2に親和性が高い。
グラム陽性菌、陰性菌及び嫌気性菌に対して幅広い抗菌スペクトルを有する(in vitro)。特に、グラム陽性菌ではブドウ球菌属、レンサ球菌属に対してすぐれた抗菌力を発揮する。グラム陰性菌では大腸菌、シトロバクター属、クレブシエラ属、エンテロバクター属、プロテウス属、インフルエンザ菌及びブランハメラ・カタラーリスに対して強い抗菌力を示し、またセラチア属、シュードモナス属、アシネトバクター属に対してもすぐれた抗菌力を示す。各種細菌の産生する染色体性β-ラクタマーゼに対して安定であるため、これらの酵素を産生する菌株に対しても強い抗菌力を示し、また耐性菌も出現しにくい(in vitro)。2)
有効成分に関する理化学的知見
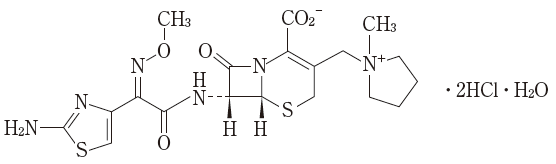
構造式
一般名
セフェピム塩酸塩水和物(Cefepime Dihydrochloride Hydrate)
略 号
CFPM
化学名
(6R,7R)-7-[(Z)-2-(2-Aminothiazol-4-yl)-2-(methoxyimino)acetylamino]-3-(1-methylpyrrolidinium-1-ylmethyl)-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate dihydrochloride monohydrate
分子式
C19H24N6O5S2・2HCl・H2O
分子量
571.50
性 状
白色〜帯黄白色の結晶又は結晶性の粉末である。
水又はメタノールに溶けやすく、エタノール(95)に溶けにくく、ジエチルエーテルにほとんど溶けない。
取扱い上の注意
安定性試験3),4)
最終包装製品を用いた加速試験(40±1℃、相対湿度75±5%、6ヵ月)の結果、セフェピム塩酸塩静注用0.5g「サンド」及びセフェピム塩酸塩静注用1g「サンド」は通常の市場流通下において3年間安定であることが推測された。
包装
セフェピム塩酸塩静注用0.5g「サンド」:1バイアル×10
セフェピム塩酸塩静注用1g「サンド」:1バイアル×10
主要文献及び文献請求先
主要文献
1
厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
2
第十七改正日本薬局方解説書(廣川書店)C-2640(2016)
3
セフェピム塩酸塩静注用0.5g「サンド」の安定性試験に関する資料(サンド株式会社社内資料)
4
セフェピム塩酸塩静注用1g「サンド」の安定性試験に関する資料(サンド株式会社社内資料)
文献請求先
主要文献に記載の社内資料につきましても下記にご請求下さい。
サンド株式会社 カスタマーケアグループ
〒105-6333 東京都港区虎ノ門1-23-1
フリーコール 0120-982-001
FAX 03-6257-3633
製造販売業者等の氏名又は名称及び住所
*製造販売
サンド株式会社
東京都港区虎ノ門1-23-1
URL:https://www.sandoz.jp/