1
(株)陽進堂社内資料:生物学的同等性試験(錠100mg)
2
(株)陽進堂社内資料:生物学的同等性試験(錠50mg)
3
原啓人 他:Thromb Haemost. 1991;65(4):415-420
4
原啓人 他:薬理と治療. 1991;19:611-618
5
土橋洋史 他:J Pharmacobiodyn. 1991;14(8):461-466
6
丸山恵子 他:J Pharmacobiodyn. 1991;14(4):177-181
5-HT2ブロッカー
1錠 32.8円
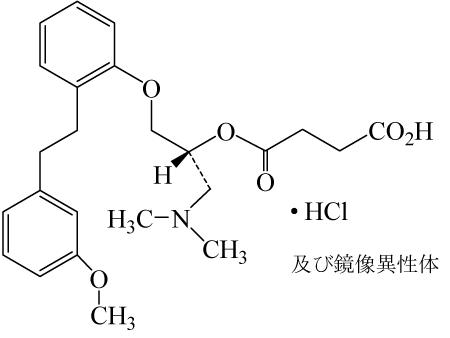
有効成分 | 1錠中、サルポグレラート塩酸塩 50mg |
|---|---|
添加剤 | ヒドロキシプロピルスターチ、セルロース、乳糖水和物、ポビドン、無水ケイ酸、クエン酸水和物、ステアリン酸Mg、ヒプロメロース、酸化チタン、マクロゴール、タルク、カルナウバロウ |
有効成分 | 1錠中、サルポグレラート塩酸塩 100mg |
|---|---|
添加剤 | ヒドロキシプロピルスターチ、セルロース、乳糖水和物、ポビドン、無水ケイ酸、クエン酸水和物、ステアリン酸Mg、ヒプロメロース、酸化チタン、マクロゴール、タルク、カルナウバロウ |
| 剤形 | 白色のフィルムコーティング錠 |
|---|---|
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 約7.1mm 大きさ(厚さ) 約3.8mm |
| 質量 | 126mg |
| 識別コード | YD966 |
| 剤形 | 白色のフィルムコーティング錠 |
|---|---|
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 約8.6mm 大きさ(厚さ) 約5mm |
| 質量 | 252mg |
| 識別コード | YD967 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
抗凝固剤 ワルファリン等 | 出血傾向を増強するおそれがある。 | 相互に作用を増強する。 |
血小板凝集抑制作用を有する薬剤 アスピリン チクロピジン塩酸塩 シロスタゾール等 | 出血傾向を増強するおそれがある。 | 相互に作用を増強する。 |
0.1~5%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|
過敏症 | 発疹、発赤 | 丘疹、そう痒 | 紅斑、蕁麻疹 |
肝臓 | 肝機能障害(ビリルビン、AST、ALT、ALP、γ−GTP、LDHの上昇等) | ||
出血傾向 | 出血(鼻出血、皮下出血等) | ||
消化器 | 嘔気、胸やけ、腹痛、便秘 | 異物感(食道)、食欲不振、腹部膨満感、下痢 | 嘔吐、口内炎 |
循環器 | 心悸亢進 | 息切れ、胸痛、ほてり | |
精神神経系 | 頭痛 | 眠気、味覚異常、めまい | |
腎臓 | 蛋白尿、尿潜血、BUN上昇、クレアチニン上昇 | ||
血液 | 貧血 | 血小板減少 | 白血球減少 |
その他 | 血清中性脂肪の上昇、血清コレステロールの上昇、血清アルブミンの減少、尿糖、尿沈渣 | 体重の増加、浮腫、倦怠感、血清カルシウムの減少 | しびれ感、発熱、咽頭痛、咽頭不快感、咽頭灼熱感 |
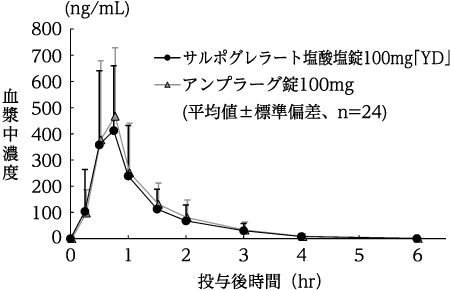
判定パラメータ | 参考パラメータ | |||
AUC0-6 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | t1/2 (hr) | |
サルポグレラート塩酸塩錠100mg「YD」 | 458.2±208.2 | 558.6±279.8 | 0.7±0.2 | 0.7±0.3 |
アンプラーグ錠100mg | 500.8±263.3 | 550.4±270.5 | 0.6±0.1 | 0.7±0.2 |
 0120-647-734
0120-647-734