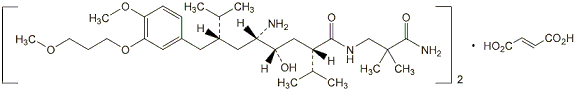
1
阿部真也ほか:周産期医学.2017; 47: 1353-1355
2
齊藤大祐ほか:鹿児島産科婦人科学会雑誌.2021; 29: 49-54
3
Tapaninen T, et al.:J Clin Pharmacol. 2011; 51: 359-367.〔RASF00064〕
4
Rebello S, et al.:J Clin Pharmacol. 2011; 51: 1549-1560.〔RASF00111〕
5
Vaidyanathan S, et al.:Cardiovasc Ther. 2008; 26: 238-246.〔RASM00252〕
6
Rebello S, et al.:J Clin Pharmacol. 2011; 51: 218-228.〔RASF00063〕
7
Vaidyanathan S, et al.:J Clin Pharmacol. 2008; 48: 1323-1338.〔RASM00239〕
8
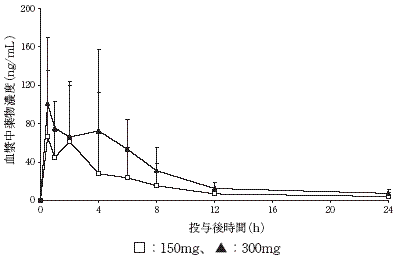
社内資料:日本人健康成人男子を対象とした単回経口投与試験〔RASU00002〕(2009年7月7日承認、CTD2.7.6.2)
9
Vaidyanathan S, et al.:Br J Clin Pharmacol. 2006; 62: 690-698.〔RASM00051〕
10
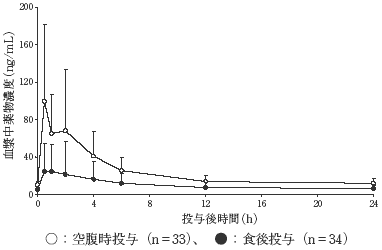
社内資料:日本人健康成人男子における食事の影響〔RASU00003〕(2009年7月7日承認、CTD2.7.6.1)
11
社内資料:外国人健康成人男子における絶対バイオアベイラビリティ〔RASU00004〕(2009年7月7日承認、CTD2.7.6.1)
12
社内資料:生物学的同等性〔RASU00005〕(2009年7月7日承認、CTD2.7.6.1)
13
社内資料:In vitroにおける血球移行及び蛋白結合〔RASU00006〕(2009年7月7日承認、CTD2.6.4.4)
14
Waldmeier F, et al.:Drug Metab Dispos. 2007; 35: 1418-1428.〔RASM00105〕
15
Vaidyanathan S, et al.:Clin Pharmacokinet. 2008; 47: 515-531.〔RASM00209〕
16
Vaidyanathan S, et al.:Clin Pharmacokinet. 2007; 46: 661-675.〔RASM00110〕
17
Vaidyanathan S, et al.:J Clin Pharmacol. 2007; 47: 192-200.〔RASM00058〕
18
Vaidyanathan S, et al.:J Clin Pharmacol. 2007; 47: 453-460.〔RASM00077〕
19
Kushiro T, et al.:Hypertens Res. 2006; 29: 997-1005.〔RASJ00010〕
20
社内資料:二重盲検法による軽症から中等症の高血圧患者に対する有効性及び安全性〔RASU00008〕(2009年7月7日承認、CTD2.7.6.4)
21
Ito S, et al.:Hypertens Res. 2010; 33: 62-66.〔RASJ00026〕
22
社内資料:重症高血圧患者に対する安全性及び有効性〔RASU00010〕(2009年7月7日承認、CTD2.7.6.4)
23
Kushiro T, et al.:Hypertens Res. 2009; 32: 169-175.〔RASJ00013〕
24
Oh B H, et al.:J Am Coll Cardiol. 2007; 49: 1157-1163.〔RASM00076〕
25
Wood J M, et al.:Biochem Biophys Res Commun. 2003; 308: 698-705.〔RASM00014〕
26
社内資料:レニンに対する阻害作用〔RASU00011〕(2009年7月7日承認、CTD2.6.2.2.1.2)
27
社内資料:高血圧患者における薬物動態及び薬力学〔RASU00007〕(2009年7月7日承認、CTD2.7.6.3)
28
社内資料:ダブルトランスジェニックラットにおける降圧作用〔RASU00012〕(2009年7月7日承認、CTD2.6.2.2.2.1)
29
Wood J M, et al.:J Hypertens. 2005; 23: 417-426.〔RASM00002〕