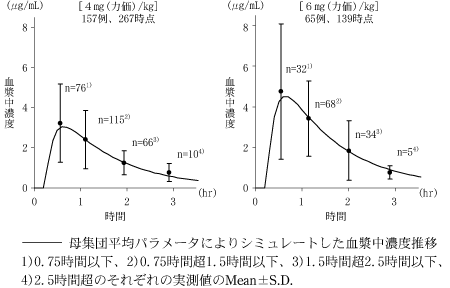
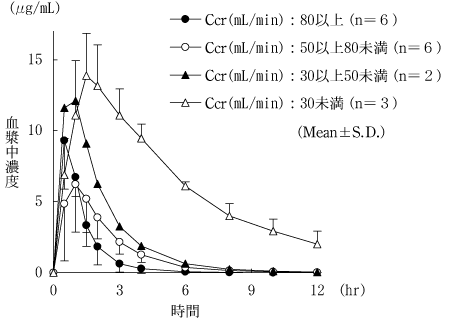
1
厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
2
藤井良知:Jpn. J. Antibiot. 1993;46(10):926-937
3
堀 誠治ほか:日本化学療法学会雑誌. 2009;57(S-1):192-204
4
社内資料:小児患者における薬物動態(2009年4月22日承認、CTD2.7.2.2)
5
木島功嗣ほか:Jpn. J. Antibiot. 2009;62(3):214-240
6
馬場駿吉ほか:Jpn. J. Antibiot. 2009;62(2):127-135
7
砂川慶介:日本化学療法学会雑誌. 2009;57(4):279-293
8
中島光好ほか:日本化学療法学会雑誌. 2009;57(S-1):90-94
9
社内資料:ヒト腎DHP-Iに対する安定性(2009年4月22日承認、CTD2.7.2.1)
10
岩田 敏ほか:日本化学療法学会雑誌. 2009;57(S-1):137-150
11
中島光好ほか:Jpn. J. Antibiot. 2009;62(2):136-142
12
中島光好ほか:日本化学療法学会雑誌. 2009;57(S-1):109-114
13
中島光好ほか:日本化学療法学会雑誌. 2009;57(S-1):99-102
14
中島光好ほか:日本化学療法学会雑誌. 2009;57(S-1):103-108
15
鈴木賢二ほか:日本化学療法学会雑誌. 2009;57(S-1):167-185
16
砂川慶介ほか:日本化学療法学会雑誌. 2009;57(S-1):115-124
17
山中 昇ほか:日本化学療法学会雑誌. 2009;57(S-1):125-136
18
馬場駿吉ほか:日本化学療法学会雑誌. 2009;57(S-1):151-166
19
菅野利恵ほか:日本化学療法学会雑誌. 2009;57(S-1):15-29
20
山田恵子ほか:日本化学療法学会雑誌. 2009;57(S-1):1-14