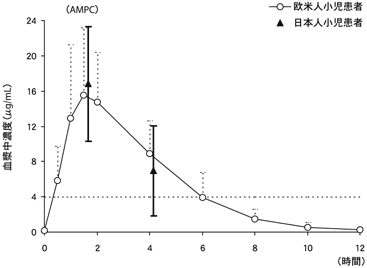
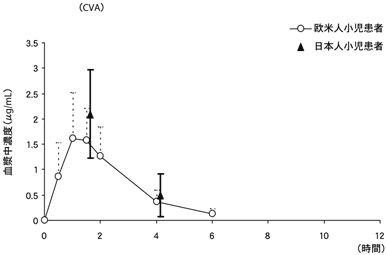
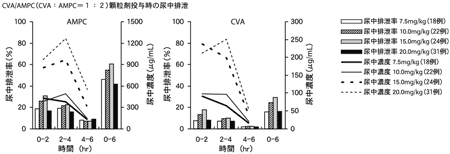
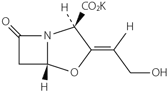
1
厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
2
Staniforth DH,et al.:J Antimicrob Chemother.1983;12:273-275
3
Borrows R,et al.:Ther Drug Monit.2007;29:122-126
4
Kenyon SL,et al.:Lancet.2001;357:979-988
5
Craig WA,et al.:Pediatr Infect Dis J.1996;15:255-259
6
松本慶蔵ほか:Chemotherapy.1982;30(S-2):81-90
7
波多野努ほか:Chemotherapy.1982;30(S-2):626-632
8
張 南薫ほか:Jpn J Antibiot.1983;36:481-486
9
酒井克治ほか:Chemotherapy.1982;30(S-2):387-396
10
伝 春光ほか:Chemotherapy.1982;30(S-2):650-661
11
河村正三ほか:Jpn J Antibiot.1983;36:500-508
12
長 和彦ほか:Jpn J Antibiot.1985;38:253-262
13
篠崎立彦ほか:Jpn J Antibiot.1985;38:269-286
14
砂川慶介ほか:Jpn J Antibiot.1985;38:319-326
15
宮地幸紀ほか:Jpn J Antibiot.1985;38:423-430
16
本廣 孝ほか:Jpn J Antibiot.1985;38:481-506
17
中山一誠ほか:Chemotherapy.1982;30(S-2):358-378
18
横田栄作ほか:Chemotherapy.1982;30(S-2):111-117
19
藤井良知ほか:Jpn J Antibiot.1998;51:709-719
20
砂川慶介ほか:化学療法の領域.1998;14:1000-1007
21
長 和彦ほか:Jpn J Antibiot.1985;38:253-262及び三井健司:基礎と臨床.1985;19:1074-1080及び斉藤 功:基礎と臨床.1985;19:1215-1223及び鈴木恵三ほか:基礎と臨床.1985;19:1835-1843を中心に集計
22
三橋 進ほか:Chemotherapy.1973;21:1355-1358
23
横田 健:日本臨床.1981;39:2-4
24
横田 健:日本臨床.1981;39:10-17
25
中沢 久ほか:Chemotherapy.1982;30(S-2):1-10
26
三木文雄ほか:Chemotherapy.1983;31(S-2):1-43
27
Woodnutt G,et al.:Antimicrob Agents Chemother.1999;43:29-34
28
五島瑳智子ほか:Chemotherapy.1982;30(S-2):20-29
29
西野武志ほか:Chemotherapy.1982;30(S-2):42-75
30
Beale AS,et al.:AUGMENTIN,Proceedings of the First Symposium.1980;127-131
31
渡辺邦友ほか:Chemotherapy.1982;30(S-2):39-41