1
Packer, M. et al.:New Engl J Med.1991;325(21):1468-1475.
2
Cohn, J. N. et al.:New Engl J Med.1998;339(25):1810-1816.
3
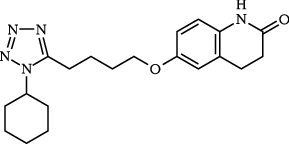
西大條亮一 ほか:医薬品研究.1985;16(5):1053-1072.
4
江崎孝三郎 ほか:医薬品研究.1985;16(5):1073-1092.
5
Akiyama, H. et al.:Arzneim-Forsch/Drug Res.1985;35(II):1124-1132.
6
Bramer, S. L. et al.:Clin Pharmacokinet.1999;37(Suppl.2):69-77.
7
永野耕一 ほか:医薬品研究.1985;16(6):1268-1284.
8
永野耕一 ほか:医薬品研究.1985;16(6):1305-1324.
9
長谷川節雄 ほか:薬理と治療.2012;40(11):955-964.
10
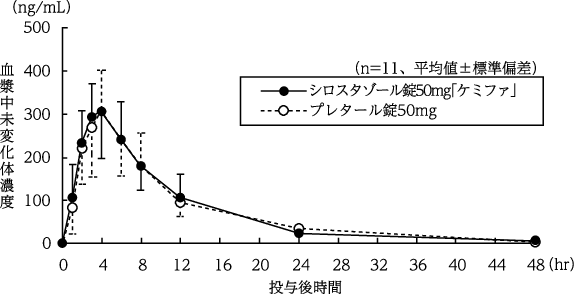
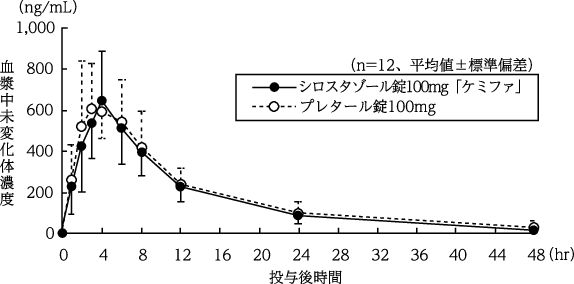
日本薬品工業株式会社:生物学的同等性に関する資料(社内資料)
11
代謝産物のタンパク結合率(プレタール錠:2003年4月16日承認、申請資料概要イ.3)
12
Akiyama, H. et al.:Arzneim-Forsch/Drug Res.1985;35(II):1133-1140.
13
発現系P450によるin vitro代謝試験(プレタール錠:2003年4月16日承認、申請資料概要ト.1.(5).1))
14
Mallikaarjun, S. et al.:Clin Pharmacokinet.1999;37(Suppl.2):33-40.
15
Bramer, S. L. et al.:Clin Pharmacokinet.1999;37(Suppl.2):25-32.
16
Mallikaarjun, S. et al.:Clin Pharmacokinet.1999;37(Suppl.2):79-86.
17
Suri, A. et al.:Clin Pharmacokinet.1999;37(Suppl.2):61-68.
18
ヒトにおけるグレープフルーツジュース、ケトコナゾール併用薬物動態試験(プレタール錠:2003年4月16日承認、申請資料概要ト.1.(5).1))
19
ヒトにおけるジルチアゼムとの併用薬物動態試験(プレタール錠:2003年4月16日承認、申請資料概要ト.1.(5).1))
20
Suri, A. et al.:Clin Pharmacokinet.1999;37(Suppl.2):53-59.
21
三島好雄 ほか:臨床評価.1986;14(1):13-41.
22
内田發三 ほか:循環器科.1985;17(4):421-432.
23
三島好雄 ほか:医学のあゆみ.1986;139(2):133-157.
24
CSPS(プレタール錠:2003年4月16日承認、申請資料概要ト.1.(3))
25
Shinohara, Y. et al.:Lancet Neurol.2010;9(10):959-968.
26
国内製造販売後臨床試験(プレタール錠/散/OD錠:2012年3月26日公表、再審査報告書)
27
血小板機能抑制作用機序(プレタール錠:2003年4月16日承認、申請資料概要ホ.1.(1))
28
Sudo, T. et al.:Biochem Pharmacol.2000;59(4):347-356.
29
血管拡張作用(プレタール錠:2003年4月16日承認、申請資料概要ホ.1.(2).2))
30
Igawa, T. et al.:Thromb Res.1990;57(4):617-623.
31
Minami, N. et al.:Life Sci.1997;61(25):383-389.
32
プロスタグランジンI2及びアデノシン存在下での血小板凝集抑制作用(プレタール錠:2003年4月16日承認、申請資料概要ホ.1.(1).4))
33
Kimura, Y. et al.:Arzneim-Forsch/Drug Res.1985;35(II):1144-1149.
34
Matsumoto, Y. et al.:Thromb Res.1999;95(1):19-29.
35
Kohda, N. et al.:Thromb Res.1999;96(4):261-268.
36
ラットにおける連続投与での血小板凝集抑制作用(プレタール錠:2003年4月16日承認、申請資料概要ホ.1.(1).2))
37
勝村達喜 ほか:薬理と治療.1986;14(3):1531-1536.
38
Yasunaga, K. et al.:Arzneim-Forsch/Drug Res.1985;35(II):1189-1192.
39
Kawamura, K. et al.:Arzneim-Forsch/Drug Res.1985;35(II):1154-1156.
40
安田慶秀 ほか:脈管学.1988;28(2):135-139.
41
Watanabe, K. et al.:Arzneim-Forsch/Drug Res.1986;36(II):1022-1024.
42
後藤文男 ほか:臨床評価.2000;27(3):615-643.
43
摘出血管における弛緩作用(プレタール錠:2003年4月16日承認、申請資料概要ホ.1.(2).2))
44
Kawamura, K. et al.:Arzneim-Forsch/Drug Res.1985;35(II):1149-1154.
45
無麻酔ラットにおける脳血流量増加作用(プレタール錠:2003年4月16日承認、申請資料概要ホ.1.(2).2))
46
Kamiya, T. et al.:Arzneim-Forsch/Drug Res.1985;35(II):1201-1203.
47
Yasuda, K. et al.:Arzneim-Forsch/Drug Res.1985;35(II):1198-1200.
48
Ohashi, S. et al.:Arzneim-Forsch/Drug Res.1985;35(II):1203-1208.
49
Kobayashi, S. et al.:Arzneim-Forsch/Drug Res.1985;35(II):1193-1197.
50
Hayashi, S. et al.:Hypertension.2000;35(1):237-243.
51
Ishizaka, N. et al.:Atherosclerosis.1999;142(1):41-46.
52
Hashimoto, A. et al.:Atherosclerosis.2006;189(2):350-357.
53
Omi, H. et al.:Microvasc Res.2004;68(2):119-125.
54
Otsuki, M. et al.:Atherosclerosis.2001;158(1):121-128.
55
Nishio, Y. et al.:Horm Metab Res.1997;29(10):491-495.
56
内皮細胞に対する保護作用(プレタール錠:2003年4月16日承認、申請資料概要ホ.1.(2).3))