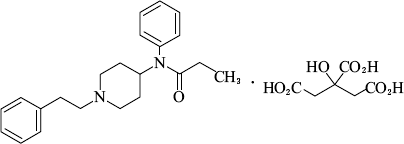
麻酔用鎮痛剤
1管 261円
| pH | 4.5〜6.5 |
|---|---|
| 浸透圧比(生理食塩液対比) | 約0.01 |
| 外観 | 無色澄明な液 |
| pH | 4.5〜6.5 |
|---|---|
| 浸透圧比(生理食塩液対比) | 約0.01 |
| 外観 | 無色澄明な液 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| **ナルメフェン塩酸塩水和物 セリンクロ | 本剤の離脱症状があらわれるおそれがある。また、本剤の効果が減弱するおそれがある。緊急の手術等によりやむを得ず本剤を投与する場合、患者毎に用量を漸増し、呼吸抑制等の中枢神経抑制症状を注意深く観察すること。また、手術等において本剤を投与することが事前にわかる場合には、少なくとも1週間前にナルメフェン塩酸塩水和物の投与を中断すること(「禁忌」の項参照)。 | μオピオイド受容体拮抗作用により、本剤の作用が競合的に阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 中枢神経系抑制剤 フェノチアジン系薬剤、ベンゾジアゼピン系薬剤、バルビツール酸系薬剤等 *全身麻酔剤 MAO阻害剤 三環系抗うつ剤 骨格筋弛緩剤 鎮静抗ヒスタミン剤 アルコール オピオイド剤 | 中枢神経抑制作用が増強されることがあるので、減量投与など注意すること。 | 相加的に中枢神経抑制作用が増強される。 |
| セロトニン作用薬 選択的セロトニン再取り込み阻害剤(SSRI)、セロトニン・ノルアドレナリン再取り込み阻害剤(SNRI)、MAO阻害剤等 | セロトニン症候群(不安、焦燥、興奮、錯乱、発熱、発汗、頻脈、振戦、ミオクローヌス等)があらわれるおそれがある。 | 相加的にセロトニン作用が増強するおそれがある。 |
| CYP3A4阻害作用を有する薬剤 リトナビル、フルコナゾール、ボリコナゾール等 | 本剤のAUCが上昇し、呼吸抑制等の副作用が発現するおそれがあるので、観察を十分に行い、慎重に投与すること。 | 肝代謝酵素CYP3A4に対する阻害作用により、本剤の代謝が阻害される。 |
| CYP3A4誘導作用を有する薬剤 リファンピシン、カルバマゼピン、フェノバルビタール、フェニトイン等 | 本剤の血中濃度が低下し、治療効果が減弱するおそれがある。必要に応じて本剤の用量調整を行うこと。 | 肝代謝酵素CYP3A4に対する誘導作用により、本剤の代謝が促進される。 |