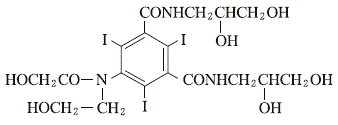
非イオン性造影剤
1筒 4968円
| pH | 6.0〜7.5 |
|---|---|
| 浸透圧比(生理食塩液に対する比) | 約2 |
| 粘稠度(mPa・s,37℃) | 2.9 |
| 色調・性状 | 無色澄明の液 |
| 剤形 | 注射剤(シリンジ) |
| pH | 6.0〜7.5 |
|---|---|
| 浸透圧比(生理食塩液に対する比) | 約2 |
| 粘稠度(mPa・s,37℃) | 5.8 |
| 色調・性状 | 無色澄明の液 |
| 剤形 | 注射剤(シリンジ) |
| pH | 6.0〜7.5 |
|---|---|
| 浸透圧比(生理食塩液に対する比) | 約2 |
| 粘稠度(mPa・s,37℃) | 5.8 |
| 色調・性状 | 無色澄明の液 |
| 剤形 | 注射剤(シリンジ) |
| pH | 6.0〜7.5 |
|---|---|
| 浸透圧比(生理食塩液に対する比) | 約3 |
| 粘稠度(mPa・s,37℃) | 8.2 |
| 色調・性状 | 無色澄明の液 |
| 剤形 | 注射剤(シリンジ) |
| pH | 6.0〜7.5 |
|---|---|
| 浸透圧比(生理食塩液に対する比) | 約3 |
| 粘稠度(mPa・s,37℃) | 8.2 |
| 色調・性状 | 無色澄明の液 |
| 剤形 | 注射剤(シリンジ) |
| 撮影の種類 | オプチレイ240注シリンジ | オプチレイ320注シリンジ | オプチレイ350注シリンジ 100mL | オプチレイ350注シリンジ 135mL |
| 脳血管撮影 | ― | 5〜15mL | ― | ― |
| 血管心臓撮影:心腔内撮影 | ― | ― | 20〜40mL | ― |
| 血管心臓撮影:冠状動脈撮影 | ― | ― | 3〜8mL | ― |
| 大動脈撮影 | ― | 30〜50mL | 30〜50mL | ― |
| 選択的血管撮影 | ― | 5〜60mL | 5〜60mL | ― |
| 四肢血管撮影 | ― | 10〜50mL | ― | ― |
| ディジタルX線撮影法による動脈性血管撮影 | ― | 3〜50mL | ― | ― |
| ディジタルX線撮影法による静脈性血管撮影 | ― | 30〜60mL | ― | ― |
| コンピューター断層撮影における造影 | 100〜150mL | 50〜100mL | ― | ― |
| 腹部のコンピューター断層撮影における造影 | ― | ― | 90〜150mL 体重に応じて1.71mL/kgを静脈内投与する。1回量は150mLを超えないこと。 | 90〜150mL 体重に応じて1.71mL/kgを静脈内投与する。1回量は150mLを超えないこと。 |
| 静脈性尿路撮影 | ― | 40〜100mL | ― | ― |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| ビグアナイド系糖尿病用薬 メトホルミン塩酸塩 ブホルミン塩酸塩 等 | X線ヨード造影剤との併用により乳酸アシドーシスを起こすことがある。 本剤を使用する場合には、ビグアナイド系糖尿病用薬を一時的に中止する等処置を行う。 | ビグアナイド系糖尿病用薬の腎排泄が減少し、血中濃度が上昇すると考えられている。 |
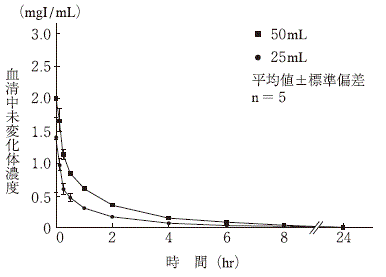
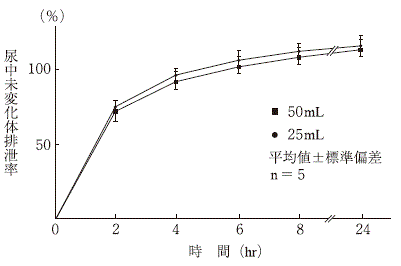
| 副作用症状 | 1〜<3時間 | 3〜<6時間 | 6〜<24時間 | 24時間〜 | |
| 過敏症 | 発疹 | 1 | 1 | 2 | 6 |
| そう痒感 | 1 | 1 | |||
| じん麻疹 | 2 | 1 | 1 | ||
| 潮紅 | 1 | ||||
| 湿疹 | 1 | ||||
| 循環器 | 血圧低下 | 1 | |||
| 消化器 | 嘔気 | 2 | 2 | ||
| 嘔吐 | 1 | 2 | |||
| 下痢 | 1 | ||||
| 腹痛 | 1 | ||||
| 上腹部痛 | 1 | ||||
| 精神神経系 | 頭痛 | 1 | 1 | 1 | |
| その他 | 浮腫・腫脹等 | 3 | 4 |