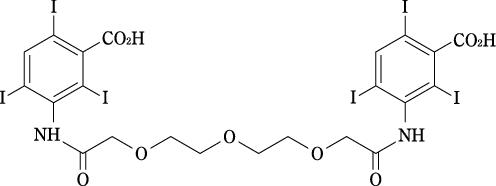
1
Taenzer V, et al.: RöFo. 1977; 126: 262-267
2
社内資料: 131I-meglumine iotroxateのヒトへの1回静注後の薬物動態的検討
3
斎藤達雄他: 胆と膵. 1981; 2: 889-906
点滴静注胆囊・胆管造影剤
1瓶 2951円
有効成分 | 1mL中日局イオトロクス酸 79.83mg含有 |
|---|---|
有効成分 | 1mL中メグルミン 25.63mg含有 |
添加剤 | 塩化ナトリウム 3.7mg/mL エデト酸カルシウムナトリウム水和物 0.1mg/mL 炭酸水素ナトリウム 0.4mg/mL pH調整剤 適量 |
| 内容量 | 100mL |
| ヨード濃度 | 50mg/mL |
| 1瓶中のヨード含有量 | 5g |
| pH | 6.4~7.5 |
|---|---|
| 浸透圧比 | 約1(生理食塩液に対する比) |
| 色・性状 | 無色~微黄色澄明の注射液 |
| 粘稠度 | 0.9mPa・s、37℃ |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
ビグアナイド系糖尿病用剤 メトホルミン塩酸塩、ブホルミン塩酸塩等 | 類薬で乳酸アシドーシスを起こしたとの報告があるので、異常が認められた場合には、ビグアナイド系糖尿病用剤の減量若しくは投与を中止するなど適切な処置を行うこと。 | ビグアナイド系糖尿病用剤の腎排泄が減少し、血中濃度が上昇するためと考えられている。 |
1%以上 | 1%未満 | 頻度不明 | |
|---|---|---|---|
過敏症 | そう痒、発疹 | 紅斑、発赤、じん麻疹 | |
循環器 | 動悸 | 血管痛、頻脈 | チアノーゼ、不整脈、虚脱、潮紅、顔面潮紅、血圧低下、蒼白 |
呼吸器 | 咳 | 喘息発作、呼吸停止、頻呼吸、鼻炎、咽頭炎 | |
消化器 | 悪心、口内乾燥 | 嘔吐、下痢 | 口内異常感、便意、腹痛 |
精神神経系 | めまい、頭痛 | 不安感、あくび | |
内分泌系 | 甲状腺機能低下症 | ||
その他 | 熱感 | 倦怠感、悪寒 | 胸内苦悶感、季肋部痛、しびれ感、冷汗 |
点滴時間 | 点滴速度 | 点滴終了後撮影至適時間 |
30分 | 1滴/1秒 | 15~90分 |
45分 | 1滴/1.5秒 | 15~75分 |
60分 | 1滴/2秒 | 15~60分 |
造影部位 | 造影効果の有効率(検査回数) |
胆のう | 89.1%(245/275) |
総胆管 | 95.1%(274/288) |
総肝管 | 93.4%(269/288) |
肝内胆管 | 85.1%(245/288) |