1
山本 勝ほか.: 基礎と臨床. 1984; 18(3): 785-90.
2
山本 勝ほか.: 基礎と臨床. 1984; 18(3): 791-7.
3
大谷隆俊ほか.: 日本口腔外科学会雑誌. 1984; 30(5): 705-16.
4
松矢篤三ほか.: 日本口腔外科学会雑誌. 1984; 30(5): 717-25.
5
Bodor N, et al.: J Med Chem. 1983; 26(3): 318-28.
噴霧式口内炎治療剤
1カプセル 34.5円
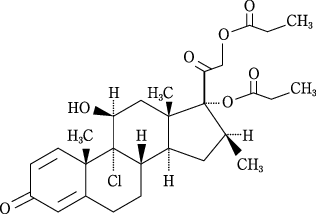
有効成分 | 日局 ベクロメタゾンプロピオン酸エステル 1カプセル中50μg |
|---|---|
添加剤 | ヒドロキシプロピルセルロース ステアリン酸マグネシウム ステアリン酸 |
| 剤形 | カプセル剤(外用) |
|---|---|
| 外形 | 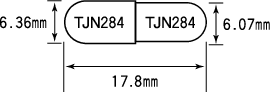 |
| 質量 | 約267mg |
| 識別コード | TJN284 |
| 色調・性状 | ボディが帯微青白色、キャップが青色の2号硬カプセル剤 |
0.1~5%未満 | 0.1%未満 | |
|---|---|---|
過敏症 | 蕁麻疹等の発疹、紅斑、そう痒、浮腫等 | |
口腔の感染症注) | カンジダ症 | |
消化器 | 腹部不快感 |