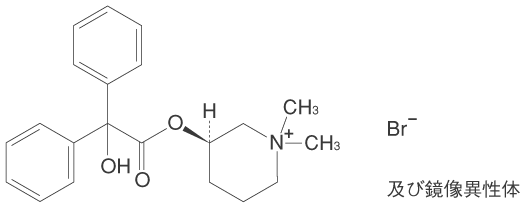
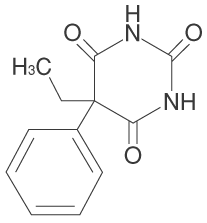
1
第十七改正日本薬局方解説書 廣川書店 2016;C5527-C5530[TR-00055]
2
第十七改正日本薬局方解説書 廣川書店 2016;C4403-C4408[TR-00054]
3
Buckley, J. P. et al.:J. Am. Pharm. Assoc. 1957;46(10):592-594[TR-01035]
4
Chen, J. Y. P.:Arch. Int. Pharmacodyn. Ther. 1959;121(1~2):78-84[TR-01033]
5
日野貞雄:日本消化器病学会雑誌1967;64(10):943-947[TR-01051]
6
Long, J. P. and Keasling, H. H.:J. Am. Pharm. Assoc. 1954;43(10):616-619[TR-01019]




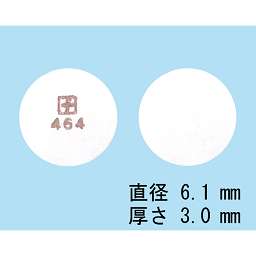
 464
464