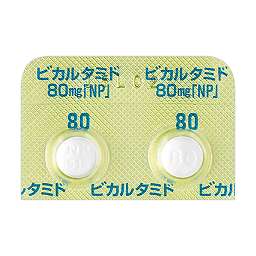
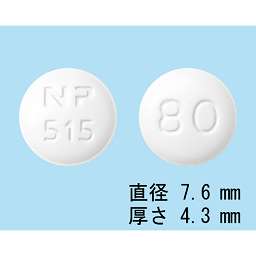
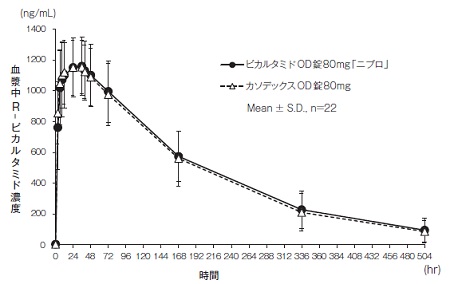
1
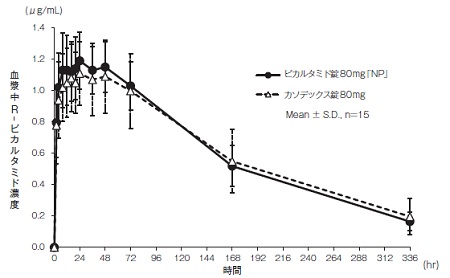
社内資料:生物学的同等性試験(錠80mg)
2
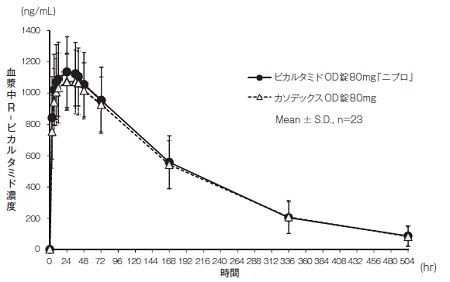
社内資料:生物学的同等性試験(OD錠80mg、水あり投与)
3
社内資料:生物学的同等性試験(OD錠80mg、水なし投与)
4
Furr BJA, et al. Hormone Dependent Cancer. Pasqualini, JR, Katzenellenbogen BS, (Eds). Marcel Dekker, New York;1996:397-424(L20220007)
5
Cockshott ID. Clin Pharmacokinet. 2004;43(13):855-878(L20220008)
6
Kaisary A, et al. Anti-Cancer Drugs. 1996;7:54-59(L20220009)
7
第十八改正日本薬局方解説書. 2021:C-4254-C-4262(L20230983)
8
赤倉功一郎. 排尿障害プラクティス. 2011;19(2):173-177(L20230984)