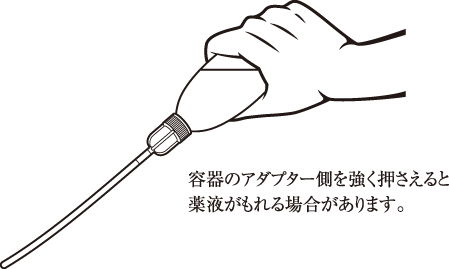
1
第十七改正日本薬局方解説書 廣川書店 2016;C4969-C4974
2
井上幹夫 他:Therapeutic Research. 1991;12(8):2605-2615
3
第十七改正日本薬局方解説書 廣川書店 2016;C4943-C4949
4
第十七改正日本薬局方解説書 廣川書店 2016;C4149-C4154
5
北野厚生 他:日本消化器病学会雑誌. 1993;90(1):24-32
6
社内資料:実験的大腸潰瘍に対する効果(1991年)
ディスポーザブルステロイド注腸剤
1個 316.2円
有効成分 | 1個中 ベタメタゾンとして 3mg/100mLベタメタゾンリン酸エステルナトリウム 3.95mg/100mL |
|---|---|
添加剤 | カルボキシビニルポリマー、エデト酸ナトリウム、リン酸水素ナトリウム、水酸化ナトリウム |
有効成分 | 1個中 ベタメタゾンとして 1.5mg/50mLベタメタゾンリン酸エステルナトリウム 1.975mg/50mL |
|---|---|
添加剤 | カルボキシビニルポリマー、エデト酸ナトリウム、リン酸水素ナトリウム、水酸化ナトリウム |
| 剤形・性状 | 注入剤(直腸内) わずかに白濁した粘性の液剤で、においはない。 |
|---|---|
| 外形 | 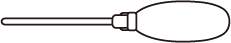 アダプター:橙色 |
| 全長(mm) | 281 |
| 剤形・性状 | 注入剤(直腸内) わずかに白濁した粘性の液剤で、においはない。 |
|---|---|
| 外形 | 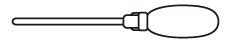 アダプター:青色 |
| 全長(mm) | 256 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
デスモプレシン酢酸塩水和物(ミニリンメルト)(男性における夜間多尿による夜間頻尿) | 低ナトリウム血症が発現するおそれがある。 | 機序不明。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
バルビツール酸誘導体 フェノバルビタール フェニトイン リファンピシン | 本剤の作用が減弱することが報告されているので、併用する場合には用量に注意すること。 | バルビツール酸誘導体、フェニトイン、リファンピシンはチトクロームP-450を誘導し、本剤の代謝が促進される。 |
サリチル酸誘導体 アスピリン アスピリンダイアルミネート サザピリン 等 | 併用時に本剤を減量すると、サリチル酸中毒を起こすことが報告されているので、併用する場合には用量に注意すること。 | 本剤はサリチル酸誘導体の腎排泄と肝代謝を促進し、血清中のサリチル酸誘導体の濃度が低下する。 |
抗凝血剤 ワルファリンカリウム | 抗凝血剤の作用を減弱させることが報告されているので、併用する場合には用量に注意すること。 | 本剤は血液凝固促進作用がある。 |
糖尿病用薬 ビグアナイド系薬剤 スルホニルウレア剤 速効型インスリン分泌促進剤 α-グルコシダーゼ阻害剤 チアゾリジン系薬剤 DPP-4阻害剤 GLP-1受容体作動薬 SGLT2阻害剤 インスリン製剤 等 | これら薬剤の作用を減弱させることが報告されているので、併用する場合には用量に注意すること。 | 本剤は肝臓での糖新生を促進し、末梢組織での糖利用を抑制する。 |
利尿剤(カリウム保持性利尿剤を除く) フロセミド アセタゾラミド トリクロルメチアジド 等 | 低カリウム血症があらわれることがあるので、併用する場合には用量に注意すること。 | 本剤は尿細管でのカリウム排泄促進作用がある。 |
シクロスポリン | 他の副腎皮質ホルモン剤の大量投与で、シクロスポリンの血中濃度が上昇するとの報告があるので、併用する場合には用量に注意すること。 | 副腎皮質ホルモン剤はシクロスポリンの代謝を抑制する。 |
エリスロマイシン | 本剤の作用が増強されるとの報告があるので、併用する場合には用量に注意すること。 | 本剤の代謝が抑制される。 |
非脱分極性筋弛緩剤 パンクロニウム臭化物 ベクロニウム臭化物 | 筋弛緩作用が減弱又は増強するとの報告があるので、併用する場合には用量に注意すること。 | 機序は不明 |
リトドリン塩酸塩 | 併用により肺水腫があらわれることがある。 | 体内の水分貯留傾向が促進される。 |
頻度不明 | |
|---|---|
過敏症 | 発疹等 |
内分泌系 | 月経異常、クッシング症候群様症状等 |
消化器 | 下痢、悪心・嘔吐、胃痛、胸やけ、腹部膨満感、口渇、食欲不振、食欲亢進等 |
精神神経系 | 多幸症、不眠、頭痛、めまい等 |
投与部位 | 局所的刺激症状(排便感増強、熱感等) |
筋・骨格 | 筋肉痛、関節痛等 |
脂質・ 蛋白質代謝 | 満月様顔貌、野牛肩、窒素負平衡、脂肪肝等 |
体液・電解質 | 浮腫、血圧上昇、低カリウム性アルカローシス等 |
眼 | 中心性漿液性網脈絡膜症等による網膜障害、眼球突出等 |
血液 | 白血球増多等 |
皮膚 | ざ瘡、多毛、脱毛、色素沈着、皮下いっ血、紫斑、線条、そう痒、発汗異常、顔面紅斑、脂肪織炎等 |
その他 | 発熱、疲労感、ステロイド腎症、体重増加、精子数及びその運動性の増減、創傷治癒障害、皮膚・結合組織の菲薄化・脆弱化、しゃっくり |
1.アルミ袋のまま温湯につけ、適温(体温程度)にあたためてから容器を取り出します。 | 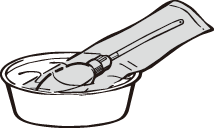 |
2.挿入する部分に潤滑剤(オリーブ油、ワセリン、グリセリン等または水)を塗ると滑らかに挿入できます。 | 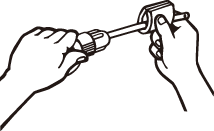 |
3.チューブを上向きにし、アダプターを左右どちらかに1回転して開封します。 ※回し過ぎてもアダプターがはずれる心配はありません。 | 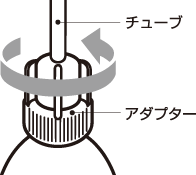 |
4.左腰を下にした体位でチューブを挿入します。 ■チューブ挿入長さの目安は5~7cmです。チューブを「赤ライン」より深く挿入すると、直腸粘膜を傷つけるおそれがあり危険です。 ※チューブ挿入の目安は、患者さまごとに変わることがあります。医師の指示に従ってください。 | 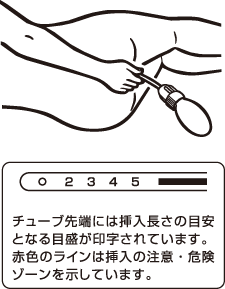 |