1
Herings RMC, et al.:Lancet. 1995;345:1195-8
2
Jhee SS, et al.:J Clin Pharmacol. 2004;44:258-64
3
入江 伸ほか:臨床医薬. 2007;23:349-56
4
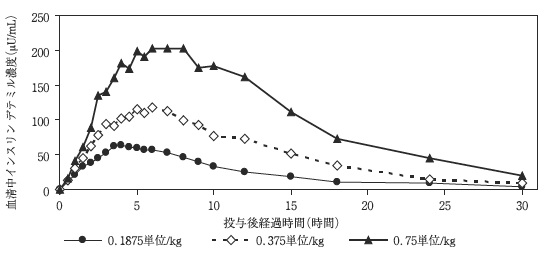
Plank J, et al.:Diabetes Care. 2005;28:1107-12
5
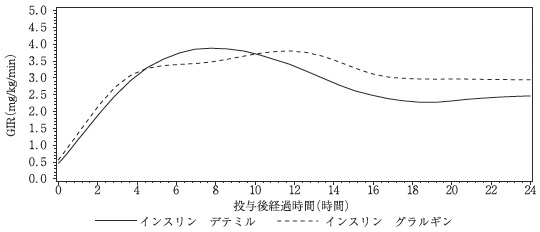
Heise T, et al.:Diabetes. 2004;53:1614-20
6
小林 正ほか:糖尿病. 2007;50:649-63
7
小林 正ほか:糖尿病. 2007;50:665-77
8
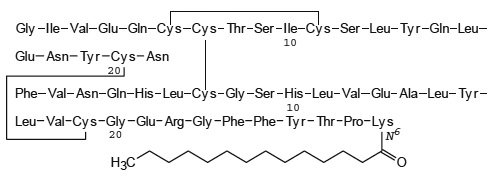
Kurtzhals P, et al.:Biochem J. 1995;312:725-31
9
Whittingham JL, et al.:Biochemistry. 1997;36:2826-31
10
Heinemann L, et al.:Diabet Med. 1999;16:332-8
11
Kurtzhals P, et al.:Diabetes. 2000;49:999-1005