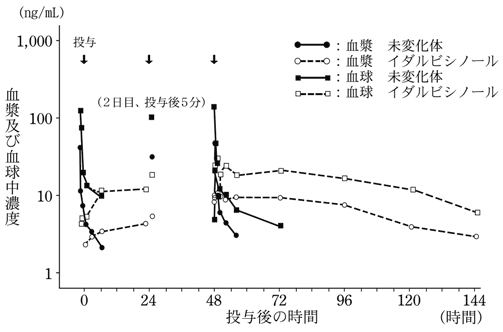
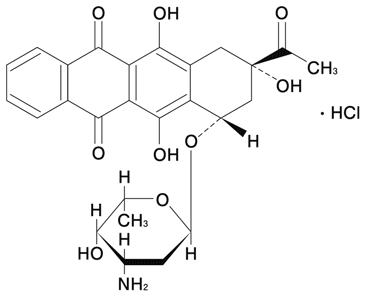
1
藤田 浩:癌と化学療法. 1992;19(6):791-798
2
Camaggi C M, et al.:Cancer Chemother Pharmacol. 1992;30(4):307-316
3
Lu K, et al.:Cancer Chemother Pharmacol. 1986;17(2):143-148
4
小川 一誠ほか:癌の臨床. 1991;37(13):1497-1504
5
小川 一誠ほか:癌と化学療法. 1993;20(7):897-906
6
小川 一誠ほか:癌と化学療法. 1993;20(7):907-914
7
正岡 徹ほか:癌と化学療法. 1993;20(13):1995-2005
8
社内資料:前治療のない成人急性骨髄性白血病に対する第Ⅲ相試験 [L20071016110]
9
Fukushima T, et al.:Int J Hematol. 1993;57(2):121-130
10
Kuffel M J, et al.:Cancer Chemother Pharmacol. 1992;30(1):51-57
11
Zunino F, et al.:Biochem Biophys Res Commun. 1976;69(3):744-750
12
Spadari S, et al.:Anticancer Res. 1986;6(5):935-940
13
Supino R, et al.:Cancer Res. 1977;37(12):4523-4528
14
Tsuruo T, et al.:Anticancer Res. 1993;13(2):357-361
15
Casazza A M, et al.:Tumori. 1980;66:549-564
16
Casazza A M.:Cancer Treat Rep. 1979;63(5):835-844