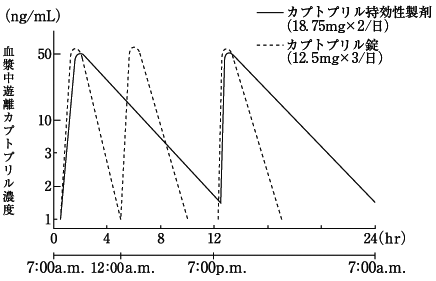
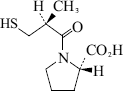
1
阿部真也 他:周産期医学. 2017;47(10):1353-1355
2
齊藤大祐 他:鹿児島産科婦人科学会雑誌. 2021;29:49-54
3
Augenstein, W.L. et al.:JAMA. 1988;259(22):3302-3305
4
Physicians' Desk Reference 49th ed. 1995;710-714
5
西村憲治 他:臨床医薬. 1986;2(6):819-826
6
塩之入洋 他:日本腎臓学会誌. 1986;28(1):73-78
7
塩之入洋 他:臨床医薬. 1986;2(6):827-833
8
金子好宏 他:臨床医薬. 1986;2(6):857-867
9
金子好宏 他:臨床医薬. 1987;3(1):21-63
10
蔵本 築 他:臨床医薬. 1986;2(11):1525-1548
11
阿部圭志 他:臨床医薬. 1988;4(5):815-837
12
Cushman, D.W. et al.:Prog Cardiovasc Dis. 1978;21(3):176-182
13
Rubin, B. et al.:J Pharmacol Exp Ther. 1978;204(2):271-280
14
Laffan, R.J. et al.: J Pharmacol Exp Ther . 1978;204(2):281-288
15
Koike, H. et al.:Hypertension . 1980;2(3):299-303
16
Rubin, B. et al.:Eur J Pharmacol. 1978;51(4):377-388
17
Antonaccio, M.J. et al.:Jpn J Pharmacol. 1979;29(2):285-294
18
Horovitz, Z.P. et al.:Br J Clin Pharmacol. 1979;7(Suppl 2):243S-248S
19
金子好宏 他:臨床医薬. 1986;2(6):835-843
20
金子好宏 他:臨床医薬. 1986;2(6):845-856